Таблица 5. Механизмы резистентности к макролидам.
По R. Leclercq, P. Courvalin (1995) [24] и N.H. Steigbigel (1995) [46]
|
1. Модификация мишени действия макролидов на уровне бактериальной клетки. При этом происходят структурные изменения в рибосомальных 50S-субъединицах, а именно, метилирование аденина в 23S-рибосомальной РНК под действием фермента метилазы эритромицинрезистентности [24]. В результате нарушается способность макролидов связываться с рибосомами и блокируется их антибактериальное действие.
Этот тип резистентности получил название MLS-типа, поскольку он может лежать в основе устойчивости микрофлоры не только к макролидам, но и к таким антибиотикам, как линкосамиды и стрептограмины. Резистентность данного типа может быть как природной (конститутивной), так и приобретенной (индуцибельной). Индукторами резистентности, усиливающими синтез метилаз, являются 14-членные макролиды, особенно эритромицин и олеандомицин. Она характерна для некоторых штаммов стрептококка группы А, золотистого стафилококка, микоплазм, листерий, кампилобактеров и других микроорганизмов. Согласно некоторым данным, резистентность по MLS-типу не вырабатывается к 16-членным макролидам (спирамицин, джосамицин), поскольку они не являются индукторами метилаз [43,44,45].
2. Активное выталкивание макролида из микробной клетки. Такой способностью обладают, например, эпидермальный стафилококк, гонококк, многие стрептококки.
3. Бактериальная инактивация макролидов. Она осуществляется посредством ферментативного расщепления лактонного кольца эстеразами (например, эритромицинэстеразой) или фосфотрансферазами (макролид 2’-фосфотрансферазой), которые могут вырабатываться золотистым стафилококком и грамотрицательными бактериями семейства Enterobacteriaceae.
Развитие резистентности к макролидам является существенной проблемой при лечении больных со СПИДом. В этом аспекте весьма важным является то, что при применении азитромицина устойчивость микрофлоры, в частности M.avium, развивается значительно реже, чем при использовании кларитромицина [47].
В исследованиях последнего времени есть указания на то, что длительное сохранение субингибиторных (суб-МПК) концентраций макролидов, в частности, азитромицина, может способствовать формированию резистентности [48]. Однако не ясно, имеет ли это клиническое значение.
Резистентность S.pneumoniae к макролидам, как показано на примере азитромицина, формируется медленнее, чем к ампициллину и цефаклору, даже при воздействии суб-МПК концентраций [49].
Макролидные антибиотики не избежали участи любых других антимикробных препаратов - появления вторичной лекарственной устойчивости. Внедрение новых 14-членных макролидов и азалидов не привело к преодолению или снижению такой устойчивости, так как у микрофлоры существует перекрестная резистентность к этим группам макролидных антибиотиков. Исключение составляют 16-членные макролиды, такие как спирамицин, которые в ряде случаев активны против грамположительных кокков, устойчивых к 14-15-членным макролидам [29].
S.aureus. До появления метициллина и других антибиотиков, стабильных к действию b-лактамаз, эритромицин часто использовался как препарат выбора для лечения стафилококковых инфекций, что привело в 1953 году к появлению устойчивых штаммов S.aureus. В настоящее время, по обобщенным данным Асаr и Goldstein (1996) [15], среди метициллинчувствительных стафилококков только 5-14% устойчивы к макролидам, в то время как среди метициллинрезистентных (MRSA) число штаммов, устойчивых к макролидам, достигает 40-90%. В различных регионах уровень резистентности варьирует и зависит от частоты использования этих антибиотиков. Уменьшение использования макролидов ведет к быстрому снижению устойчивости, что было отмечено еще в конце 50-х годов. Так, в одном из госпиталей Лондона снижение потребления эритромицина с 3,3 кг в 1958 году до 0,3 кг в 1959 году привело к падению уровня устойчивости S.aureus к эритромицину с 18% до 3% [50]. Насчитывают 6 фенотипов резистентности S.aureus к макролидам, наиболее распространенными являются три из них (табл. 6).
Таблица 6. Фенотипы резистентности стафилококков к макролидам.
По J.F. Acar, F.W. Goldstein (1996) [15]
|
S - чувствительный, R - резистентный.
Коагулазонегативные стафилококки (S.epidermidis и другие) имеют те же фенотипы резистентности, что и золотистый стафилококк.
Пневмококки. Эритромицинрезистентные пневмококки впервые были выявлены в 1967 году, однако до конца 80-х годов это не имело существенного клинического значения. В то же время распространение пенициллинрезистентных S.pneumoniae привлекло внимание к возможности применения макролидов для лечения таких инфекций. В целом эффективность макролидов при таких инфекциях достаточно невелика, так как пенициллинрезистентные пневмококки в 41%, а цефотаксимрезистентные в 49% случаев также устойчивы к эритромицину и другим макролидам [51]. Причем имеется полная перекрестная резистентность к 14- и 15-членным антибиотикам, включая самый активный из них - кларитромицин. Исключение составляют 16-членные макролиды и кетолиды. Как следует из данных, представленных в таблице 7, джосамицин и спирамицин активны против пневмококков, устойчивых к пенициллину и эритромицину [29].
Таблица 7. Сравнительная активность макролидов против пенициллин/эритромицинрезистентных S.pneumoniae и эритромицинрезистентных S.pyogenes.
По К. Klugman, W. Moser (1996) [29]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
* резистентные к пенициллину и эритромицину
b-гемолитический стрептококк группы A (S.pyogenes). Первое большое наблюдение устойчивости БГСА к эритромицину было сделано в Японии в 1974-75 гг., когда частота устойчивости колебалась от 15% до 62% [52]. В 80-е годы эпидемия эритромицинрезистентных S.pyogenes была отмечена в Австралии, Англии и Финляндии. Наиболее известной из них была эпидемия в Финляндии, где уровень резистентности составил 13,3% [53].
В регионах с высоким уровнем устойчивости к эритромицину резистентные БГСА наиболее часто выделяют из зева детей первых двух лет жизни и реже всего у лиц старше 65 лет. Согласно установленной зависимости риск носительства эритромицинрезистентных БГСА уменьшается на 1% в год по мере увеличения возраста [54].
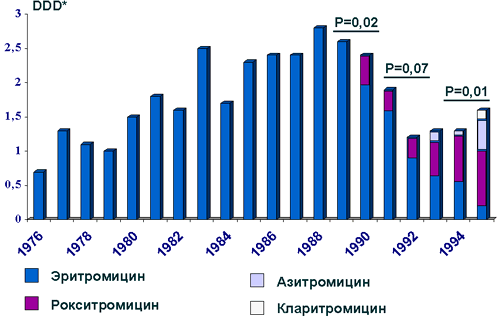
Существует связь между применением эритромицина и, вероятно, других макролидов и частотой устойчивости этого возбудителя. Это хорошо видно на примере Финляндии [55]. В период с конца 70-х до конца 80-х годов потребление эритромицина в этой стране возросло в 3 раза (рис. 4), что сопровождалось нарастанием резистентности БГСА с 5 до 19% в 1993 г.

Рис. 4. Потребление макролидов амбулаторными пациентами в Финляндии
(DDD - defined daily doses - расчетная величина, определяющая
среднюю поддерживающую дозу на 1000 населения в день).
По H. Seppala и соавт. (1997) [53]
Предпринятая в стране широкая разъяснительная кампания среди врачей привела к двукратному снижению потребления макролидов и соответствующему уменьшению резистентности до 8,6% (рис. 5). При этом общий уровень назначения антибиотиков оставался неизменным. Данное исследование показывает, что резистентность БГСА к макролидам является управляемым процессом, поскольку, во-первых, развитие резистентности к макролидам не сопровождается выработкой устойчивости к другим антибиотикам [56], а во-вторых, ограничение применения макролидов ведет к восстановлению чувствительности этого возбудителя.
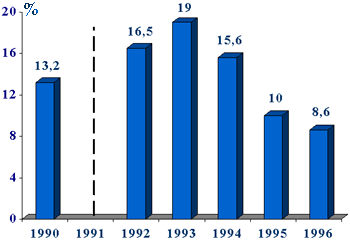
Рис. 5. Частота выделения эритромицинрезистентных БГСА в Финляндии в 1990-95 гг.
По H. Seppala и соавт. (1997) [55]
Helicobacter pylori. Устойчивость геликобактера к кларитромицину в целом составляет менее 5%, однако во Франции и Бельгии, странах с высоким потреблением макролидов в целом, уровень резистентности доходит до 10% [34]. Однако в том случае, если эрадикационная терапия оказалась неэффективной, резистентные к кларитромицину штаммы выделялись значительно чаще - в 20-60% случаев [57].
Другие микроорганизмы. Резистентность C.jejuni к макролидам варьирует от 2,4% до 11%, что было показано в исследованиях, проведенных в период с 1984 по 1991 год. Еще один представитель рода кампилобактеров - C.Coli - часто является более устойчивым, чем C.Jejuni [58]. Накапливаются данные о резистентности M.avium к новым макролидам, что требует постоянного внимания к этой проблеме, так как азитромицин и кларитромицин являются базисными препаратами для профилактики и лечения инфекций, вызванных атипичными микобактериями у больных СПИДом [59].
Таким образом, эпидемиология резистентности к макролидам требует такого же внимания, как резистентность к другим антибиотикам. Мониторинг резистентности особенно важен при респираторных инфекциях и при патологии желудочно-кишечного тракта, связанный с H.pylori, вследствие того, что макролиды стали одним из основных классов антибиотиков, применяемых при этих заболеваниях. Значение таких исследований будет определяться не столько их объёмом, сколько использованием стандартизированных и валидированных методов определения чувствительности.
Многим макролидам присущ постантибиотический эффект, под которым понимается персистирующее ингибирование жизнедеятельности бактерий после их кратковременного контакта с антибактериальным препаратом [60]. В основе эффекта лежат необратимые изменения в рибосомах микроорганизма, следствием чего является стойкий блок транслокации. За счет этого общее антибактериальное действие препарата усиливается и пролонгируется, сохраняясь в течение срока, необходимого для ресинтеза новых функциональных белков микробной клетки [61].
Наиболее отчетливый постантибиотический эффект, причем более длительный, чем у бензилпенициллина, макролиды проявляют против S.pneumoniae (табл. 8). Кроме того, эритромицин и спирамицин обладают подобным эффектом против S.aureus, а кларитромицин, рокситромицин и азитромицин - против S.pyogenes и H.influenzae [5,62]. Азитромицин (в наибольшей степени), эритромицин и кларитромицин проявляют постантибиотический эффект против L.pneumophila [63]. Постантибиотический эффект в отношении M.catarrhalis отмечен у эритромицина и кларитромицина [64].
Таблица 8. Сравнительная длительность постантибиотического эффекта макролидов и бензилпенициллина против пневмококка.
По К. Fuursted и соавт. (1997) [65]
|
Некоторые макролиды обладают так называемым "постантибиотическим суб-МПК эффектом", свидетельствующим о том, что ингибирующее влияние антибиотиков на микроорганизмы сохраняется и после снижения их концентраций в сыворотке крови или месте локализации инфекции ниже минимальной подавляющей. Эффект суб-МПК концентраций, по-видимому, является отражением того, что рибосомальная транслокация может блокироваться небольшими концентрациями макролидов. Следствием такого эффекта может быть снижение вирулентности микрофлоры. В связи со структурно-функциональными изменениями, происходящими под влиянием субингибирующих концентраций макролидов, бактерии становятся более чувствительными к действию естественных защитных сил макроорганизма [5].
Постантибиотический суб-МПК эффект макролиды могут демонстрировать in vitro и in vivo даже в отношении устойчивых к ним микроорганизмов [66,67]. Так, при длительном воздействии в суб-МПК концентрации эритромицин, азитромицин и кларитромицин оказывают бактерицидный эффект на P.aeruginosa, особенно мукоидные штаммы. В то же время другие макролиды (олеандомицин, джосамицин), а также такие мощные антисинегнойные препараты, как цефтазидим и тобрамицин, не обладают подобной активностью [68].
Гипотетическая схема действия макролидов на P.aeruginosa при длительном действии субингибирующих концентраций представлена на рисунке 6. В респираторном тракте пациентов с персистирующей синегнойной инфекцией бактерии обитают на поверхности клеток, формируя микроколонии, которые образуют биопленку. В процессе своего размножения они продуцируют вирулентные факторы, которые повреждают клетки макроорганизма, стимулируют выработку медиаторов воспаления, повышают проницаемость капилляров, вызывают лейкоцитарную инфильтрацию [69].
При применении макролидов микроорганизмы, непосредственно прилегающие к эпителиальным клеткам, могут частично подвергнуться воздействию высоких концентраций антибиотика. Его же суб-МПК концентрации могут снижать вирулентность P.aeruginosa. Более того, в условиях продолжительного поддержания субингибирующих концентраций антибиотик может повышать чувствительность микроорганизма к бактерицидному действию сыворотки. В дальнейшем P.aeruginosa прогрессивно теряет свою жизнеспособность, что ведет к клиническому улучшению, несмотря на продолжающееся выделение бактерий с макротой.
Таким образом, предполагается, что длительная терапия макролидами видоизменяет характер взаимодействия патогена с макроорганизмом, трансформируя его из инфекции в относительно доброкачественную колонизацию. А у некоторых больных при этом наблюдается и эрадикация возбудителя. С феноменом "трансформации инфекции в колонизацию" может быть связано нередко наблюдаемое при длительном применении макролидов более быстрое улучшение клинических и лабораторных показателей по сравнению с бактериологическими параметрами [69].
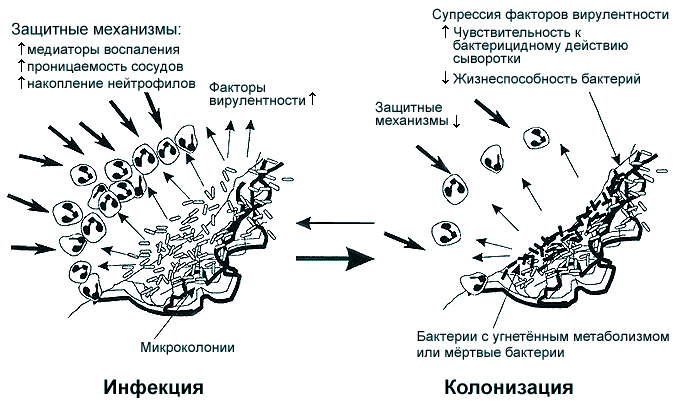
Рис. 6. Гипотетическая схема действия макролидов на P.aeruginosa
при длительном поддержании субингибирующих концентраций.
По K.Tateda и соавт. (1996) [69]
14- и 15-членные макролиды тормозят образование альгината биопленок, которые формирует P.aeruginosa. Вероятным механизмом такого действия является ингибирование одного из ферментов, участвующих в синтезе альгината, - гуанозин-D-манноза-дегидрогеназы.
Ингибирующее действие макролидов зависит не от числа атомов углерода в лактонном кольце, а от остатка сахара, соединенного с кольцом в положении 5. Так, при отщеплении от мидекамицина микарозы на его поверхности появляется микаминоза, которая по строению близка к концевому сахару эритромицина и азитромицина - дезозаминозе (соединение СР-4305).
Именно антиальгинатное и, следовательно, антибиоплёночное действие обеспечивает клиническую эффективность макролидов при диффузном панбронхиолите и, возможно, муковисцидозе, так как в патогенезе и клинике этих заболеваний существенное значение имеет иммунная реакция, вызванная альгинатом слизи.
Синергизм между ципрофлоксацином и макролидами можно объяснить тем, что вследствие антиальгинатного действия 14/15-членных макролидов возрастает проникновение ципрофлоксацина внутрь биопленки [635].
Определенное значение для антибактериальной активности макролидов имеет их взаимодействие с нейтрофилами. Благодаря своей способности проникать внутрь нейтрофилов и создавать в них высокие концентрации, многие макролиды позитивным образом модифицируют функции данных клеток, влияя, в частности, на хемотаксис, активность фагоцитоза и киллинга (табл. 9). Так, например, рокситромицин, джосамицин и, в меньшей степени, эритромицин усиливают нейтрофильный фагоцитоз и киллинг S.aureus [70,71], эритромицин повышает активность нейтрофилов против листерий [72], а азитромицин - против хламидий [73].
Таблица 9. Влияние макролидов на функции нейтрофилов in vitro.
По М.Т. Labro и соавт. (1993) [74]
|
![]() - усиление,
- усиление, ![]() - ослабление,
- ослабление, ![]() - отсутствие влияния
- отсутствие влияния
* - зависит от дозы, техники и хемоаттрактанта
** - зависит от дозы, техники и стимула
*** - синергизм с пероксидазными системами
Предполагается существование двух механизмов взаимодействия макролидов с нейтрофилами, которые благоприятно отражаются на конечном эффекте. Во-первых, отмечается прямой синергизм между бактерицидным действием нейтрофилов и антибактериальной активностью макролидов. Во-вторых, имеет место непрямой синергизм, то есть снижение вирулентности бактерий при низких концентрациях макролидов, что ведет к повышению активности нейтрофилов.
При применении 14-членных макролидов, являющихся производными эритромицина А, происходит ингибирование окислительного "взрыва" и, следовательно, уменьшение образования высокоактивных окисляющих соединений - "оксидант", непосредственно осуществляющих "киллинг". За модификацию данной функции нейтрофилов отвечает L-кладиноза - углевод, являющийся компонентом структуры всех производных эритромицина А. Поэтому олеандомицин и 16-членные макролиды, не содержащие L-кладинозу, подобным действием не обладают [75]. Несмотря на то, что под влиянием эритромицина, рокситромицина, диритромицина и эритромициламина происходит ингибирование окислительного "взрыва", бактерицидная активность нейтрофилов при этом не уменьшается [74].
Еще одним важным проявлением биоактивности 14- и 15-членных макролидов является стимулирующее влияние на экзоцитоз нейтрофилов. Предполагается, что благодаря этому свойству антибиотики могут противостоять способности некоторых микроорганизмов ингибировать фаголизосомальную функцию [76].
Рядом исследователей макролиды рассматриваются как потенциальные иммуномодуляторы [77,78]. Однако их влияние на иммунитет является очень сложной и малоизученной областью. Не следует думать, что все оказываемые эффекты благоприятны. Например, в эксперименте после действия азитромицина на S.aureus последние утрачивали восприимчивость к антистафилококковому действию дефексинов, вырабатываемых нейтрофилами человека [79].
На основании данных, полученных как в экспериментальных, так и в клинических исследованиях, можно предполагать, что многие из макролидов обладают противовоспалительной активностью.
Так, эритромицин при местном применении предупреждает развитие острых воспалительных реакций у мышей, вызванных кротоновым маслом, кантаридином и другими веществами [80]. Кроме того, он ослабляет выраженность воспаления при экспериментальном перитоните, вызванном зимозаном [81]. У больных бронхиальной астмой эритромицин снижает повышенною реактивность бронхов, ослабляя, в частности, бронхоспастическую реакцию на гистамин [82]. По данным пилотного исследования, длительное (до 8 недель) назначение эритромицина в низких дозах пациентам с бронхоэктазами снижает продукцию мокроты и уменьшает в ней число лейкоцитов, не влияя на ее бактериальный состав. Это сопровождается существенным улучшением показателей функции внешнего дыхания больных [83].
Рокситромицин также проявляет противовоспалительный эффект на различных экспериментальных моделях [84]. Установлено, что по выраженности данного эффекта он превосходит кларитромицин и азитромицин [85]. Имеются ограниченные данные, согласно которым, рокситромицин, назначаемый больным бронхиальной астмой без клинических симптомов сопутствующей бактериальной инфекции, приводит к значительному улучшению их состояния. В то же время попытка замены его на тролеандомицин оказалась неудачной [86].
Противовоспалительное действие макролидов в первую очередь связывают с их антиоксидантными свойствами. Как отмечено выше, способность ингибировать окислительный "взрыв" обнаружена у эритромицина, рокситромицина, диритромицина, эритромициламина. Кроме того, эритромицин, спирамицин, рокситромицин и кларитромицин влияют на выработку цитокинов [87,88]. Еще одним механизмом может быть увеличение эндогенной продукции глюкокортикоидов. По данным японских ученых, у животных отмечается 4-кратное увеличение уровня глюкокортикоидов в сыворотке крови после введения 14-членных макролидов (эритромицин, кларитромицин). Поскольку при предварительном введении дексаметазона этот эффект не отмечался, сделан вывод о том, что в основе повышения сывороточного уровня гормонов лежит активация гипоталамо-гипофизарно-надпочечниковой системы. Применение 16-членных макролидов такого эффекта не вызывало [89].
Противовоспалительная активность имеет немаловажное значение для клинического эффекта макролидов при диффузном панбронхиолите, вызванном P.aeruginosa. Выявлено, что они (1) снижают концентрацию иммунных комплексов в сыворотке крови, (2) тормозят выработку альгината микроорганизмом in vitro и (3) ослабляют реакцию антиген-антитело, инициируемую альгинатом, как in vitro, так и in vivo. Такой способностью обладают только 14- и 15-членные макролиды [90].
Прокинетическим эффектом, то есть способностью стимулировать моторику желудочно-кишечного тракта, обладают 14-членные макролиды, в наибольшей степени - эритромицин. Он рассматривается как агонист рецепторов, чувствительных к эндогенному стимулятору моторики мотилину [91]. Клинически прокинетический эффект может проявляться нежелательными реакциями в виде болей в животе, тошноты, рвоты, диареи. Имеются данные о практическом использовании прокинетического эффекта эритромицина с целью устранения гастропареза у больных сахарным диабетом [92].
При приеме внутрь макролиды всасываются в желудочно-кишечном тракте и по системе воротной вены попадают в печень, где могут сразу же частично метаболизироваться. Определенное количество активного препарата экскретируется по желчевыводящим путям в кишечник и подвергается повторной абсорбции (энтерогепатическая циркуляция).
Из печени макролиды транспортируются по печеночной вене в правые отделы сердца, а оттуда - в легкие, где значительная часть препарата может задерживаться. После прохождения через "легочный" барьер макролиды снова возвращаются к сердцу (левые отделы), а затем с артериальной кровью распределяются по всему организму. Они депонируются в мышцах, селезенке, печени, почках и многих других органах, создавая высокие тканевые концентрации и проникая при этом внутрь клеток (рис. 7).
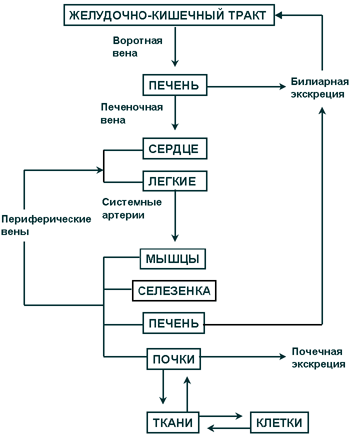
Рис. 7. Общая схема фармакокинетики макролидов.
По J.D. Williams, A.M. Sefton (1993) [25]
Только та часть препарата, которая не депонировалась при прохождении через органы и ткани, попадает в системный венозный кровоток, где концентрация антибиотика может быть количественно определена.
Экскреция макролидов осуществляется преимущественно через билиарную систему и частично через почки.
После приема внутрь макролиды в желудке могут частично разрушаться под действием соляной кислоты. Наиболее подвержены ее деструктивному действию эритромицин и олеандомицин. Спирамицин и новые макролиды, особенно кларитромицин, характеризуются более высокой кислотоустойчивостью. Повышенную устойчивость к кислоте имеют также кишечнорастворимые лекарственные формы макролидов и некоторые эфиры, например, эритромицина стеарат.
Степень и скорость всасывания в кишечнике зависят от вида препарата, характера его эфира и лекарственной формы, а также от наличия пищи.
Пища может оказывать существенное влияние на биодоступность макролидов. Всасывание многих из них, в особенности эритромицина, в присутствии пищи снижается. Однако при использовании эритромицина в виде некоторых эфиров, она может либо не изменяться (эстолат), либо даже возрастать (этилсукцинат, стеарат). Пища практически не влияет на биодоступность эритромицина при приеме его в форме кишечнорастворимых гранул. Биодоступность спирамицина, диритромицина и кларитромицина в присутствии пищи также заметно не изменяется [7,93]. Всасывание рокситромицина и азитромицина под влиянием пищи может значительно замедляться [94].
Пиковые концентрации макролидов в сыворотке крови при приеме внутрь и величины, отражающие площадь под фармакокинетической кривой, зависят от вида препарата и его дозы (табл. 10). С повышением дозы антибиотика его биодоступность, как правило, увеличивается.
Таблица 10. Сравнительная фармакокинетика макролидов
По T. Bergan (1995) [93] и E. Bergogne-Berezin (1996) [61]
|
Тmax - время достижения пиковой концентрации в крови,
Сmax - величина пиковой концентрации,
* - при внутривенном введении в дозе 15-20 мг/кг
Наиболее высокие сывороточные концентрации отмечаются при приеме рокситромицина, что можно связывать с его относительно низким тканевым аффинитетом. Для этого препарата может быть характерна обратная зависимость биодоступности от дозы. Так, по данным Nilsen (1987) [95], площадь под фармакокинетической кривой при приеме 150 мг рокситромицина составляет 54, при приеме 300 мг - 44, а при приеме 450 мг - 37 мг х час/л.
Самые низкие концентрации в крови характерны для азитромицина, что, теоретически, может создавать проблемы при инфекциях, сопровождающихся бактериемией. Время достижения пиковой концентрации несколько отличается у различных препаратов и варьирует от 1 часа (джосамицин) до 4-4,5 часов (диритромицин).
Важным элементом фармакокинетики макролидов, который отмечается довольно часто, является наличие двух пиков концентрации в крови [93]. Наиболее четко это было показано на примере эритромицина и азитромицина, но наблюдается также и при приеме других препаратов. У эритромицина величина второго сывороточного пика может даже превышать уровень первого. При приеме азитромицина параллельно второму пику в сыворотке отмечается повторный подъём концентрации в других биологических жидкостях, в частности, в лимфе. Феномен второго пика обусловлен тем, что значительная часть препарата, первичного депонирования в желчном пузыре, впоследствии вместе с желчью (в ответ на прием пищи) поступает в кишечник и всасывается.
При внутривенном введении макролидов, как и любых других препаратов, очень быстро развиваются высокие концентрации в крови. Они превышают уровни, которые достигаются при оральном приеме тех же самых антибиотиков, так как в данном случае не происходит потерь при всасывании и первичном прохождении антибиотиков через ткани.
Макролиды в различной степени связываются с белками плазмы, главным образом, с a1-гликопротеинами. Наибольшим связыванием характеризуется рокситромицин (92-96%), наименьшим - спирамицин (10-18%) (рис. 8).
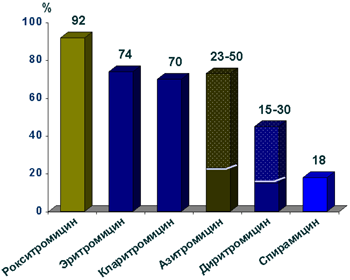
Рис. 8. Связывание макролидов с белками плазмы.
Сводные данные T.Bergan (1995) [93]
Все макролидные антибиотики хорошо распределяются в организме, проникая во многие органы, ткани и среды организма. По способности проходить через различные гисто-гематические барьеры (за исключением гемато-энцефалического) макролиды превосходят b-лактамные антибиотики и аминогликозиды.
Важным достоинством большинства макролидов является их способность создавать очень высокие и длительно сохраняющиеся тканевые концентрации, превышающие уровень препаратов в сыворотке крови. Так, при использовании эритромицина его концентрации в тканях в 5-10 раз выше, чем в сыворотке. Наиболее высокие тканевые уровни, в 10-100 раз превышающие концентрации в крови, отмечаются при применении азитромицина. Исключение составляет рокситромицин, который, в отличие от других препаратов, создает менее высокие концентрации в тканях, чем в крови, что, по-видимому, обусловлено высокой степенью связывания его с белками плазмы.
Макролиды накапливаются в высоких концентрациях в миндалинах, среднем ухе, придаточных пазухах носа, легких, бронхолегочном секрете, плевральной и перитонеальной жидкостях, лимфатических узлах, органах малого таза (включая предстательную железу), причем в условиях воспаления проницаемость препаратов в соответствующий очаг увеличивается. Концентрации макролидных антибиотиков, создаваемые в этих органах и средах, превышают их МПК для основных патогенов. Макролиды проникают через плаценту и экскретируются в грудное молоко.
Макролиды плохо проникают через гемато-энцефалический и гемато-офтальмический барьеры, создавая низкие концентрации в ликворе и тканях глаза.
В отличие от многих других антибиотиков макролиды хорошо проникают внутрь клеток организма человека и создают высокие внутриклеточные концентрации, что имеет чрезвычайно важное значение при лечении инфекций, вызванных внутриклеточными патогенами (Mycoplasma spp., Chlamydia spp., Legionella spp., Campylobacter spp. и другие). Существенным является также то, что макролидные антибиотики (в наибольшей степени азитромицин и кларитромицин) способны проникать внутрь фагоцитарных клеток, таких как макрофаги, фибробласты, нейтрофилы, и с ними транспортироваться в воспалительный очаг. При этом, как уже было указано выше, макролиды могут оказывать положительное влияние на функцию нейтрофилов. Способностью аккумулироваться в фагоцитах обладают также некоторые другие антибиотики (фторхинолоны, клиндамицин, рифампицин), однако для макролидов характерны наиболее высокие соотношения концентраций между внутриклеточной средой и внеклеточным пространством [36].
Макролиды метаболизируются в печени при участии микросомальной мультиферментной системы цитохрома Р450 (изоформа CYP 3A4) [96]. В процессе биотрансформации образуются как неактивные метаболиты, так и соединения, обладающие антибактериальным действием (например, 14-гидрокси-кларитромицин). Метаболиты выделяются преимущественно с желчью и далее со стулом. Почечная экскреция неизмененных препаратов в целом незначительна и составляет 5-10%. Выведение через почки может возрастать при высоких концентрациях антибиотика в крови.
Продолжительность периода полувыведения отличается у различных макролидов и может зависеть от дозы (табл. 10). Наибольший период полувыведения имеют азитромицин и диритромицин - до 65 часов, наименьшим обладают эритромицин и джосамицин - около 1,5 часов.
У больных с почечной недостаточностью величина периода полувыведения большинства макролидов не изменяется, поэтому коррекции режимов дозирования не требуется. Исключение составляют кларитромицин и рокситромицин, экскреция которых при почечной недостаточности может замедляться. При циррозе печени может значительно возрастать период полувыведения эритромицина и джосамицина, в то время как у рокситромицина, азитромицина и диритромицина этот фармакокинетический параметр существенно не меняется.
| © 2000-2007 НИИАХ СГМА |
|