|
|
 |
|
|||||||||||||||||||
|
Состояние резистентности к антиинфекционным химиопрепаратам в РоссииНа протяжении последних лет во всем мире отмечается значительный рост устойчивости возбудителей внебольничных и нозокомиальных инфекций к АМП. Возникновение антимикробной резистентности является естественным биологическим ответом на использование АМП, которые создают селективное давление, способствующее отбору, выживанию и размножению резистентных штаммов микроорганизмов. Резистентность к АМП имеет огромное социально-экономическое значение и в развитых странах мира рассматривается как угроза национальной безопасности. Инфекции, вызванные резистентными штаммами, отличаются длительным течением, чаще требуют госпитализации и увеличивают продолжительность пребывания в стационаре, ухудшают прогноз для пациентов. При неэффективности препаратов выбора приходится использовать средства второго или третьего ряда, которые, зачастую, более дороги, менее безопасны и не всегда доступны. Все это увеличивает прямые и непрямые экономические затраты, а также повышает риск распространения резистентных штаммов в обществе. Выделяют несколько уровней резистентности к АМП - глобальный, региональный и локальный. Прежде всего, необходимо учитывать глобальные тенденции в развитии резистентности. Примерами микроорганизмов, которые во всем мире стремительно вырабатывают резистентность к существующим АМП, являются стафилококки, пневмококк, гонококк, синегнойная палочка и др. При этом следует помнить, что антибиотикорезистентность не является тотальной, не распространяется на все микроорганизмы и АМП. Так, S.pyogenes и T.pallidum остаются универсально чувствительны к β-лактамам; H.influenzae - к цефотаксиму или цефтриаксону. Однако при всей важности учета глобальной картины при планировании политики антимикробной терапии более рационально опираться на данные, полученные в конкретной стране (региональные данные). Несомненно, что в такой огромной стране, как Российская Федерация, существуют значительные территориальные вариации распространения резистентности к АМП. В связи с этим неоспоримо значение территориального мониторирования резистентности и доведение его результатов до врачей различных специальностей. В каждом лечебно-профилактическом учреждении необходимо иметь локальные данные по рези-стентности (паспорт резистентности). В первую очередь это относится к отделениям с высокой частотой применения АМП: ОРИТ, ожоговые, урологические и др. Сведения о резистентности следует приводить дифференцированно, по различным отделениям и микроорганизмам. Паспорт резистентности должен быть изложен в письменном виде и его следует регулярно, минимум один раз в год, обновлять. Удобным является его издание в виде приложения к формулярному справочнику. Данные о состоянии резистентности в России носят разрозненный характер, зачастую они получены с нарушением методологии определения чувствительности, что ставит под сомнение их достоверность. Кроме того, наряду с этим абсолютно необходимо знать и преобладающие механизмы резистентности, в том числе на локальном уровне, что необходимо для выбора рациональной терапии. Основной проблемой определения чувствительности микроорганизмов в России является отсутствие стандартизированных методик тестирования. Единственные существующие в нашей стране официальные рекомендации - "Методические указания по определению чувствительности микроорганизмов к антибиотикам методом диффузии в агар с использованием дисков" Минздрава СССР (1983 г.) - не описывают методики определения чувствительности "прихотливых" микроорганизмов, в частности S.pneumoniae, H.influenzae и N.gonorrhoeae, не содержат методик определения МПК, не включают критерии интерпретации для современных антибиотиков (цефалоспорины, фторхинолоны, карбапенемы). Более того специальные исследования показали, что рекомендуемая в этих документах среда АГВ непригодна для определения чувствительности к ряду АМП. В связи с этим значительное число данных о чувствительности различных микроорганизмов к антибиотикам, полученных в микробиологических лабораториях страны, не может быть оценено и проанализировано. С осторожностью также следует относиться к публикациям в отчественных и зарубежных источниках, в которых отсутствует информация о методах определения чувствительности и критериях интерпретации. В данной главе приведены результаты только тех исследований, которые выполнялись в соответствии с наиболее часто используемыми в мире стандартами NCCLS. Для удобства восприятия и с учетом сложившейся клинической практики, рассматриваемые микроорганизмы были подразделены на внебольничные и нозокомиальные. Более подробную информацию по предоставленным в настоящей главе данным можно получить в Научно-методическом центре Минздрава РФ по мониторингу антибиотикорезистентности 214019, г. Смоленск, а/я № 5 ВОЗБУДИТЕЛИ ВНЕБОЛЬНИЧНЫХ ИНФЕКЦИЙStreptococcus pneumoniae. В последнее десятилетие отмечается появление и распространение в ряде стран пенициллинорезистентных пневмококков, а также штаммов, устойчивых к макролидным антибиотикам, хлорамфениколу, тетрациклинам и ко-тримоксазолу. При этом в некоторых регионах резистентность к макролидам превалирует над устойчивостью к пенициллину. У здоровых детей дошкольного возраста из организованных коллективов (Москва, Смоленск и Ярцево) в среднем 7,5% пневмококков, выделенных из носоглотки, были умеренно резистентны к пенициллину (МПК 0,12-1 мг/л). Не было обнаружено штаммов с высоким уровнем резистентности (МПК і 2 мг/л). Все штаммы с умеренной устойчивостью к пенициллину были чувствительны к амоксициллину/клавуланату. Уровень резистентности к макролидным антибиотикам составил 4,6%. Наиболее высокий уровень резистентности был отмечен к ко-тримоксазолу - 56,8% пневмококков. По данным многоцентрового исследования "ПеГАС-1" умеренно резистентные к пенициллину штаммы S.pneumoniae составили 7%, при этом 2% штаммов имели МПК пенициллина і 2 мг/л. Все штаммы с промежуточной устойчивостью к пенициллину сохраняли чувствительность к цефалоспоринам. Частота резистентности к эритромицину составила 6,2%. Наиболее существенной проблемой является устойчивость S.pneumoniae к тетрациклину (27,1%) и к ко-тримоксазолу (32,4%). Результаты многоцентрового исследования резистентности пневмококков, выделенных у детей 1-14 лет с инфекциями ДП (исследование CARTI, 2001), представлены на рис. 1. Рисунок 1. Резистентность (%) S.pneumoniae (CARTI, 2001 г.)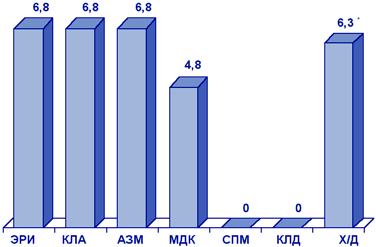 * Умереннорезистентные штаммы. Многоцентровое исследование распространенности антимикробной резистентности клинических штаммов S.pneumoniae, проведенное в 2000-2001 гг. Научно-методическим центром Минздрава РФ по мониторингу антибиотикорезистентности и НИИ антимикробной химиотерапии (г. Смоленск) в различных регионах России, выявило значительные региональные вариации лекарственной устойчивости (табл. 1). Штаммы пневмококка со сниженной чувствительностью к пенициллину встречались редко, за исключением центров из Сибири, где были обнаружены не только умереннорезистентные к пенициллину изоляты, но и штаммы с МПК 4-8 мг/л. Таблица 1. Резистентность (%) клинических штаммов S. pneumoniae в различных регионах России
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Регион (N) | ПЕН | ТЛМ | ЭРИ | АЗМ | КЛА | КЛД | ЛВФ | Х/Д |
|---|---|---|---|---|---|---|---|---|
| Центральный (75) | 5,3 | 0 | 4 | 4 | 4 | 1,3 | 0 | 0 |
| Северо-Западный (323) | 2,5 | 0 | 1,9 | 1,9 | 1,9 | 0,6 | 0 | 0 |
| Южный (10) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Урал (8) | 0 | 0 | 1,3 | 1,3 | 1,3 | 1,3 | 0 | 0 |
| Сибирь (52) | 13,5 | 0 | 3,8 | 3,8 | 3,8 | 1,9 | 0 | 0 |
| Все (468) | 4,1 | 0 | 2,6 | 2,6 | 2,6 | 1,1 | 0 | 0 |
Сокращения:
ПЕН - пенициллин; ТЛМ - телитромицин; ЭРИ - эритромицин;
АЗМ - азитромицин; КЛА - кларитромицин; КЛД - клиндамицин;
ЛВФ - левофлоксацин; Х/Д - хинупристин/дальфопристин.
Резистентность пневмококков к макролидам была обусловлена, преимущественно, активным выведением антибиотиков из бактериальных клеток и изменением мишени действия (метилирование рибосом). Однако впервые были обнаружены штаммы с новыми механизмами устойчивости (мутации в 23S рРНК и рибосомальных белков L4).
Проспективное исследование резистентности пневмококков, выделенных при инфекциях ДП у госпитализированных пациентов в нескольких стационарах Москвы в 1998-1999 гг. и 2000-2001 гг., продемонстрировало некоторое снижение частоты резистентности к пенициллину и, в меньшей степени, к макролидам (табл. 2).
| Период | ЭРИ | КЛА | АЗМ | СПМ | КЛД | ПЕН | ХФ | ТЕТ | ТСМ |
|---|---|---|---|---|---|---|---|---|---|
| 1998-1999 | 12,1 | НД | 14,3 | 14,8 | 9,5 | 23,7 | 12,6 | 42,6 | 35,6 |
| 2000-2001 | 8,4 | 6,6 | 7,9 | 7,5 | 1,8 | 10,0 | 35,8 | 22 | НД |
Сокращения:
НД - нет данных; ЭРИ - эритромицин; КЛА - кларитромицин;
АЗМ - азитромицин; СПМ - спирамицин; КЛД - клиндамицин;
ПЕН - пенициллин; ХФ - хлорамфеникол; ТЕТ - тетрациклин;
ТСМ - ко-тримоксазол.
Streptococcus pyogenes отличается высокой и полной чувствительностью к пенициллинам и цефалоспоринам. β-лактамы остаются единственным классом антибиотиков, к которым у S.pyogenes не развилась резистентность. Актуальной проблемой является устойчивость к макролидам, которая в некоторых регионах мира превышает 30%.
Результаты первого многоцентрового исследования резистентности S.pyogenes в России, проведенного в рамках исследования ПеГАС-1 в 2000 г., представлены на рис. 2.
Сокращения:
ПЕН - пенициллин; ЭРИ - эритромицин; АЗМ - азитромицин;
КЛА - кларитромицин; КЛД - клиндамицин; ТЕТ - тетрациклин;
ЛВФ - левофлоксацин.
Многоцентровое исследование резистентности клинических штаммов S.pyogenes, проведенное в 2000-2001 гг., позволило изучить распространенность устойчивости прежде всего к макролидам в различных регионах России (табл. 3). Частота резистентности к эритромицину варьировала и достигала 11,4%, при этом не было обнаружено штаммов, устойчивых к телитромицину, представителю нового класса антибиотиков - кетолидов. Почти в 90% случаев резистентность к макролидам была обусловлена метилированием рибосом, в остальных случаях она была связана с активным выведением (эффлюксом) антибиотика из клетки.
| Регион (N) | ПЕН | ТЛМ | ЭРИ | АЗИ | КЛА | КЛД | ЛВФ | Х/Д |
|---|---|---|---|---|---|---|---|---|
| Центральный (45) | 0 | 0 | 8,9 | 8,9 | 8,9 | 0 | 0 | 0 |
| Северо-Западный (498) | 0 | 0 | 11,4 | 11,4 | 11,4 | 0,4 | 0 | 0 |
| Южный (10) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Урал (31) | 0 | 0 | 3,2 | 3,2 | 3,2 | 6,5 | 0 | 0 |
| Сибирь (16) | 0 | 0 | 25 | 25 | 25 | 0 | 0 | 0 |
| Все (468) | 0 | 0 | 11 | 11 | 11 | 0,7 | 0 | 0 |
Сокращения:
ПЕН - пенициллин; ТЛМ - телитромицин; ЭРИ - эритромицин;
АЗМ - азитромицин; КЛА - кларитромицин; КЛД - клиндамицин;
ЛВФ - левофлоксацин; Х/Д - хинупристин/дальфопристин.
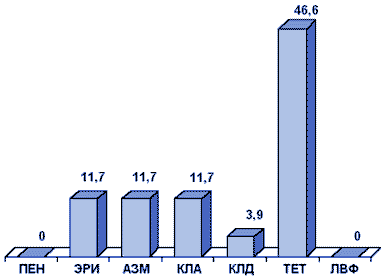
Haemophilus influenzae. Основным механизмом устойчивости H.influenzae к аминопенициллинам (ампициллину и амоксициллину) является продукция плазмидных β-лактамаз. Согласно данным, полученным при исследовании в Москве, Смоленске и Ярцево в 1998 г., продукция β-лактамаз пока не является существенной проблемой: резистентность к ампициллину составила 2,3%.
Наибольшее значение имеет резистентность H.influenzae к ко-тримоксазолу, которая составила 20,9% (рис.3).
Сокращения:
АМП - ампициллин; АМК - амоксициллин/клавуанат; ЦФМ - цефуроксим;
ЦТМ - цефотаксим; АЗМ - азитромицин; ТЕТ - тетрациклин;
ЦИП - ципрофлоксацин; ХФ - хлорамфеникол; ТСМ - ко-тримоксазол.
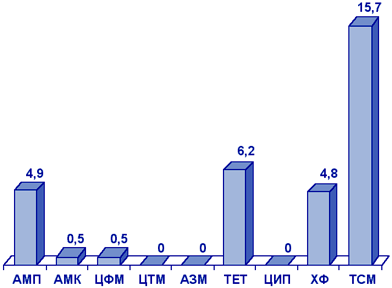
Neisseria gonorrhoeae. Определение чувствительности гонококков представляет трудную задачу и требует использования специальных питательных сред, поэтому в России практически отсутствуют достоверные данные о резистентности N.gonorrhoeae к АМП.
Результаты исследования чувствительности гонококков в Москве и Смоленске в 2000 г. представлены на рис. 4. Примечателен высокий уровень резистентности гонококков к пенициллину, тетрациклину. Обращает внимание устойчивость гонококков в Москве к спектиномицину (23%) и ципрофлоксацину (7%), причем в последнем случае за счет резистентных, а не умеренно резистентных, штаммов.
Сокращения:
ПЕН - пенициллин; АМК - амоксициллин/клавуанат; СКМ - спектиномицин;
ТЕТ - тетрациклин; ЦИП - ципрофлоксацин; ЦФС - цефтриаксон.
Escherichia coli является наиболее частым возбудителем внебольничных инфекций МВП. На рис. 5 представлены результаты многоцентровых исследований резистентности к антибиотикам грамотрицательных возбудителей инфекций МВП у женщин с острым и рецидивирующим циститом, находившихся на амбулаторном лечении (исследование UTIAP). В 1998 г. исследование проводилось в Москве, Смоленске и Новосибирске; в 2001 г. участвовали центры из Москвы, Санкт-Петербурга, Смоленска, Ростова-на-Дону, Екатеринбурга, Новосибирска.
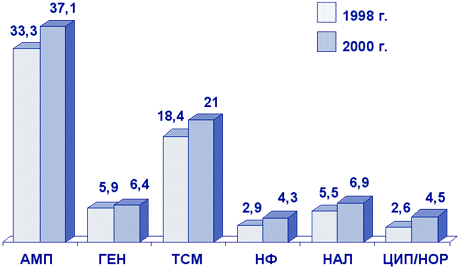
Сокращения:
AMП - ампициллин; ГЕН - гентамицин; TСМ - ко-тримоксазол; НФ - нитрофурантоин;
НАЛ - налидиксовая кислота; ЦИП - ципрофлоксацин; НОР - норфлоксацин.
Как следует из представленных данных, наиболее высокий уровень резистентности наблюдался к ампициллину (33,3%) и ко-тримоксазолу (18,4%). Наименьшая устойчивость отмечалась к фторхинолонам.
При сравнительном анализе результатов исследований в 1998 г. и в 2000 г. отмечается повсеместный небольшой рост резистентности ко всем исследовавшимся АМП, в том числе к фторхинолонам (ципрофлоксацин, норфлоксацин).
В 2000 г. было проведено первое многоцентровое исследование резистентности к АМП возбудителей внебольничных инфекций МВП у детей - исследование АРМИД-2000. Наиболее частым возбудителем во всех центрах-участниках была E.coli (табл. 4). Обращает на себя внимание высокий уровень устойчивости E.coli к амоксициллину (31-67,6%) и ко-тримоксазолу (17,2-45,9%). Наименьшая резистентность отмечалась к амоксициллину/клавуланату, фосфомицину, ципрофлоксацину, налидиксовой кислоте, гентамицину и нитрофурантоину.
| АМП | Москва, N=85 |
С.-Петербург, N=36 |
Смоленск, N=73 |
Казань, N=45 |
Оренбург, N=26 |
Иркутск, N=37 |
Н.-Новгород, N=29 |
|---|---|---|---|---|---|---|---|
| Амоксициллин | 49,4 | 48,6 | 57,5 | 48,9 | 50 | 67,6 | 31 |
| Амоксициллин/ клавуланат | 1,2 | 8,6 | 5,5 | 4,4 | 0 | 8,1 | 0 |
| Цефуроксим | 0 | 8,6 | 5,5 | 13,3 | 0 | 0 | 0 |
| Цефоперазон | 1,2 | 8,6 | 5,5 | 13,3 | 0 | 0 | 0 |
| Цефтриаксон | 0 | 2,9 | 2,7 | 11,1 | 0 | 0 | 0 |
| Цефотаксим | 0 | 2,9 | 2,7 | 8,9 | 0 | 0 | 0 |
| Цефтазидим | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Цефтибутен | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Цефепим | 0 | 2,9 | 1,4 | 2,2 | 0 | 0 | 0 |
| Имипенем | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Налидиксовая кислота |
9,4 | 2,9 | 6,8 | 8,9 | 0 | 0 | 17,2 |
| Ципрофлоксацин | 1,2 | 0 | 2,7 | 4,4 | 0 | 0 | 13,8 |
| Гентамицин | 4,7 | 5,7 | 11 | 15,5 | 3,8 | 13,5 | 0 |
| Нетилмицин | 2,4 | 2,9 | 2,7 | 0 | 3,8 | 2,7 | 0 |
| Амикацин | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Фосфомицин | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Ко-тримоксазол | 32,9 | 34,3 | 39,7 | 35,6 | 38,5 | 45,9 | 17,2 |
| Нитрофурантоин | 5,9 | 0 | 1,4 | 2,2 | 0 | 0 | 0 |
Вторым по частоте возбудителем инфекций МВП у детей в амбулаторных условиях была K.pneumoniae (рис. 6), наибольшей активностью в отношении которой обладали ципрофлоксацин, налидиксовая кислота и фосфомицин.
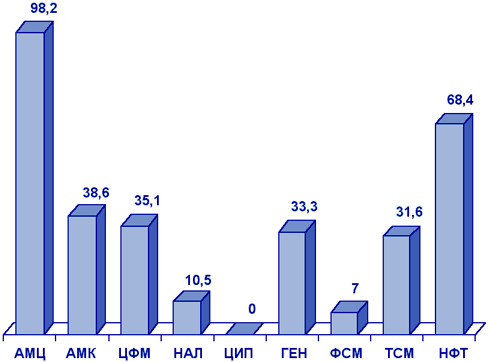
Сокращения:
АМЦ - амоксициллин; АМК - амоксициллин/клавуанат; ЦФМ - цефуроксим;
НАЛ - налидиксовая кислота; ЦИП - ципрофлоксацин; ГЕН - гентамицин;
ФСМ - фосфомицин; ТСМ - ко-тримоксазол; НФT - нитрофурантоин.
Shigella flexneri и Shigella sonnei. Результаты многоцентрового исследования чувствительности шигелл, проведенного в 1998-2000 гг., представлены в табл. 5 Наибольшей резистентностью отличались штаммы S.flexneri, которые практически полностью были устойчивы к аминопенициллинам, ко-тримоксазолу, тетрациклину и хлорамфениколу, с незначительными вариациями в различных центрах. Все штаммы Shigella spp. были чувствительны к ципрофлоксацину, норфлоксацину, налидиксовой кислоте (исключение - Москва, где 2,3% штаммов были устойчивы) и цефотаксиму.
| АМП | S.flexneri | S.sonnei | |||||
|---|---|---|---|---|---|---|---|
| Брянск, (N=14) |
Москва, (N=44) |
С.-Петербург, (N=29) |
Смоленск, (N=89) |
Брянск, (N=64) |
С.-Петербург, (N=21) |
Смоленск, (N=192) |
|
| Ампициллин | 100 | 95,5 | 96,6 | 95,5 | 10,9 | 38,1 | 30,7 |
| Ампициллин/ сульбактам | 92,9 | 93,2 | 100 | 95,5 | 9,4 | 33,3 | 29,7 |
| Ко-тримоксазол | 92,9 | 100 | 65,5 | 96,6 | 75 | 95,2 | 96,4 |
| Тетрациклин | 92,9 | 100 | 100 | 97,8 | 62,5 | 66,7 | 92,2 |
| Хлорамфеникол | 100 | 95,5 | 100 | 93,3 | 26,6 | 66,7 | 45,8 |
| Ципрофлоксацин | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Норфлоксацин | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Налидиксовая кислота | 0 | 2,3 | 0 | 0 | 0 | 0 | 0 |
| Цефотаксим | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Представленные в табл. 6 данные о резистентности шигелл, выделенных в Екатеринбурге, также показывают, что S.sonnei были менее резистентны к пенициллинам и тетрациклину, по сравнению с S.flexneri. Исключение составляет ко-тримоксазол, к которому резистентность у S.sonnei была значительно выше. Особый интерес представляют данные о появлении резистентности шигелл к ципрофлоксацину.
| АМП | АМС | ЦФТ | ЦФС | ТЕТ | ЦИП | ТСМ | |
|---|---|---|---|---|---|---|---|
| S.flexneri (n=53) |
98,1 | 98,2 | 0 | 20,4 | 91,8 | 3,8 | 73,6 |
| S.sonnei (n=41) |
7,3 | 7,3 | 2,4 | 0 | 66,7 | 4,9 | 97,6 |
Сокращения:
АМП - ампициллин; АМС - ампициллин/сульбактам; ЦФТ - цефотаксим;
ЦФС - цефтриаксон; ТЕТ - тетрациклин; ЦИП - ципрофлоксацин;
ТСМ - ко-тримоксазол.
Salmonella spp. Как видно из табл. 7, антибиотикорезистентность у сальмонелл пока не представляет реальной угрозы. Не было выявлено штаммов, устойчивых к цефотаксиму, ципрофлоксацину и ко-тримоксазолу. Наибольшая резистентность наблюдалась к тетрациклину (10,5%) и хлорамфениколу (9,5%).
| АМП | АМС | ЦТМ | НАЛ | ЦИП | НОР | ХФ | ТЕТ | ТСМ | |
|---|---|---|---|---|---|---|---|---|---|
| S.enteritidis | 2,7 | 2,7 | 0 | 2,7 | 0 | 0 | 6,7 | 4 | 0 |
| Salmonella spp. | 6,3 | 6,3 | 0 | 3,2 | 0 | 0 | 9,5 | 10,5 | 0 |
Сокращения:
АМП - ампициллин, АМС - ампициллин/сульбактам, ЦТМ - цефотаксим,
НАЛ - налидиксовая кислота, ЦИП - ципрофлоксацин, НОР - норфлоксацин;
ХФ - хлорамфеникол, ТЕТ - тетрациклин, ТСМ - ко-тримоксазол.
Однако представленные данные не отражают всей картины антибиотикорезистентности в России. Так в Санкт-Петербурге в 1996 г. были выделены клинические штаммы S.typhimurium и изоляты из окружающей среды, резистентные к цефотаксиму. Молекулярный анализ этих штаммов, а также цефотаксиморезистентных изолятов из стационаров Белоруссии, показал, что они представляют собой один клон, а резистентность к β-лактамам обусловлена одновременной продукцией БЛРС типа CTX-M и пенициллиназы типа SHV.
В Екатеринбурге в 1999 г. 16,7% сальмонелл были резистентны к ампициллину и ампициллину/сульбактаму, 13,8% к тетрациклину и 6,1% к ко-тримоксазолу. Все исследованные штаммы были чувствительны к фторхинолонам. Кроме того, был выделен клинический штамм, резистентный к цефалоспоринам III поколения, но чувствительный к фторхинолонам и ко-тримоксазолу.
Mycobacterium tuberculosis. Одной из основных ведущих причин неэффективности терапии туберкулеза является увеличение частоты множественнорезистентных M.tuberculosis, то есть устойчивых минимум к изониазиду и рифампицину.
В 1991-1994 гг. в девяти областях северо-западного региона России (Республика Коми, Псков, Новгород, Санкт-Петербург и Ленинградская область, Карелия, Вологда, Архангельск, Мурманск) частота выделения M.tuberculosis, первично резистентных к одному и более противотуберкулезным препаратам, увеличилась с 17% до 24%. Уровень вторичной резистентности существенно не изменился и составил около 50%.
В Ленинградской области в 1992-1994 гг. первичная резистентность составила 29,2%, частота выделения первичных множественнорезистентных штаммов достигала 5,1% без значительных колебаний в течение всего периода исследования. Вторичная устойчивость внелегочных изолятов в 1989-1994 гг. составила 45,6% по сравнению с 69,5% у штаммов, выделенных из респираторных образцов. Распространенность вторичных множественнорезистентных штаммов, полученных из респираторных образцов, значительно увеличилась и составила 33% по сравнению с 8,8% для внелегочных штаммов микобактерий.
В Ивановской области при тестировании 222 штаммов первичная множественная резистентность составила в 1998 г. 9%, а частота множественноустойчивых штаммов среди 54 изолятов, выделенных у пациентов, получавших ранее противотуберкулезные препараты, составила 25,9%.
В Томске (1995-1996 гг.) первичная резистентность микобактерий достигала 27,7%, множественная резистентность - 3,4%. Исследования, проведенные в 1999 г., выявили уже 6,5% (27/417) множественноустойчивых штаммов у пациентов, не получавших ранее терапию, и 26,7% (62/232) у больных, ранее лечившихся противотуберкулезными средствами.
Приведенные данные показывают, что в последние годы наблюдается выраженная тенденция роста множественной устойчивости в целом и, особенно, к двум основным препаратам для лечения туберкулеза: изониазиду и рифампицину.
S.aureus и коагулазонегативные стафилококки. В многоцентровом исследовании чувствительности стафилококков в Москве и Санкт-Петербурге (1998 г.) были выявлены различия в распространении резистентности в отдельных стационарах. При этом устойчивость к оксациллину значительно чаще встречалась среди КНС (до 65,9%), чем среди S.aureus (до 40%). В целом в Москве частота выделения MRSA составила 33,4%, в Санкт-Петербурге - 4,1%. Все резистентные к оксациллину стафилококки были чувствительны к ванкомицину, а 95%, 84% и 70% штаммов MRSA были чувствительны к фузидиевой кислоте, рифампицину и ципрофлоксацину, по сравнению с 80%, 85% и 61% КНС, соответственно.
Результаты многоцентрового исследования распространенности резистентности S.aureus в ОРИТ России (исследование СтЭнт), проведенного в 2001 г., показаны на рис. 7.
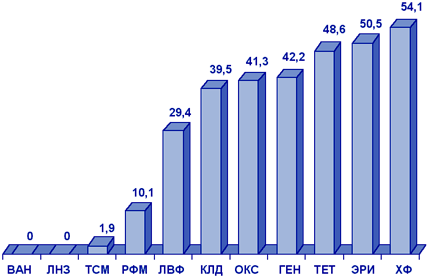
Сокращения:
ВАН - ванкомицин; ЛНЗ - линезолид; ТСМ - ко-тримоксазол;
РФМ - рифампицин; ЛВФ - левофлоксацин; КЛД - клиндамицин;
ОКС - оксациллин; ГЕН - гентамицин; ТЕТ - тетрациклин;
ЭРИ - эритромицин; ХФ - хлорамфеникол.
Enterococcus spp. В Москве и Санкт-Петербурге в 1995-1996 гг. было выявлено 16% E.faecalis, резистентных к ампициллину, при этом наблюдались значительные различия частоты устойчивости между отдельными лечебными учреждениями. Высокий уровень резистентности к аминогликозидам составил 44% к стрептомицину и 25% к гентамицину. Не было выявлено умереннорезистентных или резистентных к ванкомицину штаммов энтерококков. В отличие от E.faecalis, 75% штаммов E.faecium было устойчиво к ампициллину, чувствительность к другим антибиотикам существенно не отличалась.
С эпидемиологической целью было проведено определение чувствительности штаммов энтерококков, выделенных из кала у детей, находящихся в отделении выхаживания недоношенных новорожденных (табл. 8).
| Антибиотик | E.faecalis (N=33) | E.faecium (N=61) |
|---|---|---|
| Ампициллин | 3 | 77 |
| Гентамицин | 0 | 64 |
| Стрептомицин | 3 | 56 |
| Ванкомицин | 9* | 10* |
| Хлорамфеникол | 39 | 54 |
| Рифампицин | 88 | 93 |
| Хинупристин/ дальфопристин |
15 | 3 |
* Умереннорезистентные штаммы.
В целом E.faecium отличались более высокой резистентностью к антибиотикам, за исключением ванкомицина, активность которого в отношении всех энтерококков была сравнимой, и хинупристина/дальфопристина (3% резистентных E.faecium против 15% - E.faecalis). Только 3% E.faecalis были устойчивы к ампициллину, в отличие от 77% E.faecium. Большинство E.faecium демонстрировали высокий уровень резистентности к аминогликозидам (64% к гентамицину и 56% к стрептомицину).
В рамках многоцентрового проспективного исследования распространенности антимикробной резистентности нозокомиальных грамотрицательных возбудителей в 28 ОРИТ 15 городов России (NPRS-3), проведенного в 1997-1999 гг., были изучены 2664 микроорганизма (табл. 9, рис. 8, 9).
Семейство Enterobacteriaceae. Резистентность бактерий семейства Enterobacteriaceae широко варьирует между отдельными стационарами, во многом являясь отражением политики назначения АМП.
| E.coli (N=489) |
K.pneumoniae (N=389) |
Proteus spp. (N=263) |
Enterobacter spp. (N=203) |
|
|---|---|---|---|---|
| Ампициллин | 49,7 | - | 71,5 | 80,3 |
| Пиперациллин | 40,9 | 68,4 | 37,6 | 44,8 |
| Пиперациллин/ тазобактам |
6,3 | 30,1 | 8,7 | 29,1 |
| Амоксициллин/ клавуланат |
35,8 | 56,0 | 32,7 | 89,7 |
| Цефуроксим | 19,2 | 57,3 | 51,3 | 63,1 |
| Цефотаксим | 11,0 | 37,5 | 20,9 | 29,1 |
| Цефтриаксон | 11,5 | 40,4 | 17,5 | 30,5 |
| Цефтазидим | 7,8 | 33,7 | 6,9 | 24,6 |
| Имипенем | 0 | 0 | 0 | 0 |
| Гентамицин | 20,9 | 55,8 | 43,3 | 24,1 |
| Амикацин | 2,2 | 9,0 | 3,4 | 2,5 |
| Ципрофлоксацин | 8,4 | 12,9 | 8,7 | 5,9 |
Штаммы E.coli были наиболее резистентны к ампициллину, пиперациллину, амоксициллину/клавуланату, цефуроксиму. Максимально активным в отношении E.coli были имипенем, к которому сохраняли чувствительность все штаммы E.coli, пиперациллин/тазобактам (резистентность 6,3%), цефалоспорины III поколения: цефтазидим (резистентность 7,8%), цефотаксим и цефтриаксон (резистентность около 11%).
Отмечен высокий уровень резистентности K.pneumoniae ко всем исследованным АМП, за исключением амикацина (резистентность - 9%) и имипенема (резистентность - 0%). Штаммы Proteus spp. были наиболее резистентны к ампициллину, цефуроксиму, пиперациллину, амоксициллину/клавуланату и гентамицину. Имипенем проявлял активность в отношении всех Proteus spp., высокая активность также отмечена у цефтазидима (резистентность 6,9%) и амикацина (резистентность 3,4%). Штаммы Enterobacter spp. были высокорезистентны к пиперациллину и цефуроксиму, наиболее активным был имипенем (резистентность 0%).
Pseudomonas aeruginosa. В многоцентровом исследовании NPRS-3 (рис. 8), синегнойная палочка отличалась очень высоким уровнем резистентности к гентамицину (61,3%), а также к пиперациллину, пиперациллину/тазобактаму, ципрофлоксацину. Наиболее активными в отношении P.aeruginosa являлись амикацин (резистентность 6,7%) и цефтазидим (резистентность 11,2%).
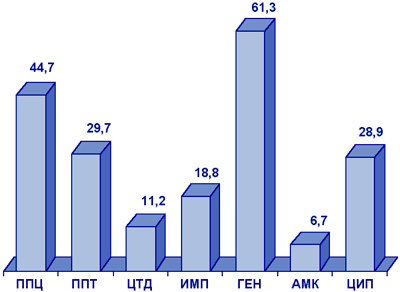
Сокращения:
ППЦ - пиперациллин; ППТ - пиперациллин/тазобактам; ЦТД - цефтазидим;
ИМП - имипенем; ГЕН - гентамицин; АМК - амикацин; ЦИП - ципрофлоксацин.
Acinetobacter spp. Штаммы Acinetobacter spp., исследованные в рамках проекта NPRS-3 (рис. 9), были наиболее резистентны к пиперациллину, пиперациллину/тазобактаму, цефтазидиму, гентамицину, ципрофлоксацину. Наиболее активными АМП в отношении Acinetobacter spp. являлись имипенем (резистентность 0%) и амикацин (резистентность 8,7%).
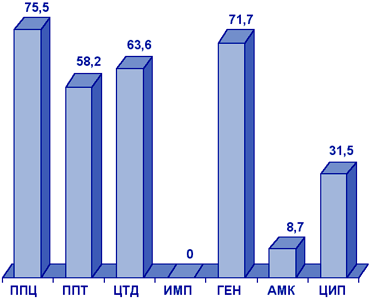
Сокращения:
ППЦ - пиперациллин; ППТ - пиперациллин/тазобактам; ЦТД - цефтазидим;
ИМП - имипенем; ГЕН - гентамицин; АМК - амикацин; ЦИП - ципрофлоксацин.
Обобщая данные исследования NPRS-3, необходимо отметить высокий уровень резистентности грамотрицательных нозокомиальных возбудителей к ампициллину, амоксициллину/клавуланату, пиперациллину, цефуроксиму и гентамицину, тогда как имипенем и амикацин были активными в отношении большинства исследованных штаммов.
В исследовании Micromax (табл. 10), выполненном в 1998 г. в 8 стационарах Москвы, Смоленска, Екатеринбурга, отмечена низкая частота устойчивости E.coli и Proteus spp. к β-лактамам с незначительными различиями между отдельными центрами. В то же время, выявлена высокая резистентность Klebsiella spp. к цефалоспоринам III поколения (31-40%). Резистентность к цефепиму была почти в два раза меньше - 16%. Не было выявлено штаммов кишечных палочек, протеев и клебсиелл, устойчивых к имипенему.
| Антибиотик | E.coli | Proteus spp. | Klebsiella spp. |
|---|---|---|---|
| Пиперациллин/тазобактам | 3 | 1 | 17 |
| Цефтриаксон | 13 | 10 | 40 |
| Цефтазидим | 5 | 3 | 31 |
| Цефепим | 3 | 3 | 16 |
| Имипенем | 0 | 0 | 0 |
| Ципрофлоксацин | 12 | 15 | 14 |
В заключение необходимо отметить, что приведенные в настоящей главе сведения, разумеется, не могут считаться исчерпывающими и далеко не в полной мере отражают состояние резистентности к АМП в России. Практически отсутствуют достоверные данные о резистентности анаэробных бактерий, вирусов и грибов. Это подчеркивает чрезвычайную важность проведения постоянного мониторинга резистентности микроорганизмов к АМП с обобщением данных, полученных с применением единой методики.
| © 2000-2007 НИИАХ СГМА |


