Р. Я. МЕШКОВАРУКОВОДСТВО ПО ИММУНОПРОФИЛАКТИКЕ ДЛЯ ВРАЧЕЙ
2.5.3. Клеточно-опосредованный иммунный ответДеление на гуморальный и клеточный иммунитет достаточно условно, т.к. в обоих случаях имеет место участие как Т-, так и В-лимфоцитов, а на вторжение инфекционного агента развиваются и гуморальный, и клеточный ответы. Более того, как внутриклеточные, так и внеклеточные патогены при попадании в организм захватываются антигенпрезентирующими клетками (АРС), чаще всего макрофагами, перерабатываются ими ипредставляются синергичным Т-хелперам и В-лимфоцитам в виде комплексов с молекулами МНС класса I или II. Антигенпрезентирующие клетки (APC)Антиген является главным регулятором иммунного ответа [10], поскольку дифференцировка примитивных Т-клеток в те или иные эффекторные клетки зависит от цитокинов, секреция которых регулируется видом захваченного АРС антигена. В периферических лимфоидных органах выделяют 3 типа специализированных АРС: Каждый из этих типов клеток специализируется на переработке и представлении антигенов для примитивных Т-клеток. В свою очередь макрофаги и В-клетки являются также мишенями последующих эффекторных действий Т-клеток. Только эти 3 типа клеток экспрессируют специализированные ко-стимуляторные молекулы, которые способны затем активировать примитивные Т-клетки. Макрофаги и В-клетки экспрессируют эти молекулы только когда активируются сами вследствие инфицирования. Макрофаги обнаруживаются во всех зонах лимфоузлов и активно захватывают микробы и другие антигены. Дендритные клетки, которые в лимфоидных тканях называют интердигитальными ретикулярными клетками – присутствуют только в Т-клеточных зонах лимфоузлов. В-клетки – присутствуют в лимфоидных фолликулах лимфоузлов и селезенки и особенно эффективны при захватывании растворимых антигенов, таких как бактериальные токсины, с которыми они связываются специфически с помощью поверхностных Ig молекул. Все специализированные АРС способны экспрессировать оба класса МНС-молекул. АРС представляют пептидные фрагменты захваченного антигена рециркулирующим Т-клеткам. В результате первого связывания примитивных Т-клеток с антигеном, презентируемым АРС, реализуется первичный иммунный ответ и генерируется иммунологическая память, которая обеспечивает защиту при последующем реинфицировании. Роль эффекторных Т-клетокДля участия в адаптивном иммунном ответе нативные (примитивные) Т-клетки должны быть активированы т.е. индуцированы к пролиферации и последующей дифференцировке в клетки, способные к удалению патогенов. Такие клетки называют эффекторными Т-клетками. Их основным свойством является способность действовать немедленно или очень быстро после связывания с МНС-пептидным комплексом на клетке-мишени. Генерация эффекторных клеток из примитивных Т-клеток идет несколько дней. В конце этого периода эффекторные Т-клетки покидают лимфоидные органы, возвращаются в кровеносное русло и могут мигрировать в места инфекций. Активация примитивных Т-клеток при первичной встрече с антигеном на поверхности профессиональных АРС называемая праймингом, требует распознавания ими чужеродных пептидных фрагментов, связанных с собственными МНС-молекулами. Кроме того, требуется одновременное поступление ко-стимулирующего сигнала от специализированных профессиональных АРС. Таким образом, Т-клетки, которые встретили специфический антиген, представленный АРС, активируются, пролиферируют и дифференцируются в эффекторные клетки, а эффекторные Т-клетки оставляют лимфоузлы через эфферентные лимфатические сосуды и входят в циркуляцию. Эффекторные Т-клетки делят на 3 функциональных класса:
Однако не все клоны Т-хелперов можно разделить на Th1 и Th2. Есть клетки, которые секретируют все типы цитокинов. Эти клетки обозначают как Т-хелперы тип 0 (Th0). Они могут быть общими прекурсорами Th1 и Th2 клеток или могут быть третьей эффекторной по-пуляцией Т-хелперов. В свою очередь, цитокины вовлекаются в регуляцию дифференцировки Th субпопуляций:
Эти факты свидетельствуют, что IFN-g и ИЛ-12 можно рассматривать в качестве иммунорегуляторов, способных вмешиваться в клональную экспансию и эффекторные функции Th2 клеток. Кроме того, при нарушении продукции ИЛ-4 Th1 клетками может происходить регуляция развития Th0 клеток в Th2, что приводит к восстановлению продукции ИЛ-4. В итоге, баланс ИЛ-4 и ИЛ-12 обеспечивает дифференцировку Th0 клеток в Th1 и Th2 [89]. Дифференцировка нативных CD4 Т-клеток в эффекторные клетки зависит от цитокинов, индукция которых регулируется главным образом антигеном [89]:
В противоположность, ингибируют генерирование воспалительных Th1 клеток цитокины ИЛ-4 и ИЛ-10, а ингибируют пролиферацию хелперных Т-клеток (Th2) – другой цитокин, а именно: IFN-g. Клетки, на которые оказывают действие эффекторные Т-клетки, называют клетками-мишенями. Таким образом, цитокины в ранней фазе инфекции влияют на функциональную дифференцировку CD4 Т-клеток. Это главная часть адаптивного иммунного ответа, обеспечивающая в ответ на антиген либо продукцию антител, либо активацию макрофагов и Т-киллеров. Помимо указанных молекул, все 3 класса эффекторных Т-клеток экспрессируют мембран-ассоциированные адгезивные эффекторные молекулы, которые, подобно цитокинам, индуци-руются благодаря распознаванию антигена на клетке-мишени и представлены соответственно: Fas-Ligand на CTL, CD40-Ligand на Th2, TNF на Th1. Механизмы T-клеточно-опосредованной цитоксичностиЭффекторные функции Т-клеток опосредуются благодаря индукции экспрессии как мембран-связанных, так и секретируемых молекул. Эффекторные Т-клетки секретируют молекулы, которые разделяются на 2 больших класса: 1. Цитотоксины - которые выделяются CD8 Т-клетками и некоторыми воспалительными (Th1) CD4. 2. Цитокины - которые выделяются всеми эффекторными Т-клетками и являются медиаторами эффекторных действий CD4 Т-клеток. Цитотоксины не являются специфическими и могут действовать на все виды клеток. Цитокины действуют благодаря специфическим рецепторам к ним на клетке-мишени, а основные эффекторные действия CD4 Т-клеток направлены именно на специализированные клетки, экспрессирующие эти рецепторы. К цитотоксинам, секретируемым CD8 Т-клетками, относятся: перфорин-1, который создает "дыру" в мембране клетки-мишени; гранзимы, которые представлены протеазой и часто IFN-a. К мембран-связанным эффекторным молекулам на CD8 Т-клетках относят Fas-ligand, связывание которого с Fas рецептором индуцирует апоптоз клетки-мишени. Апоптоз - это генетически запрограммированная гибель клетки. Как известно, все вирусы и некоторые бактерии размножаются в цитоплазме инфицированных клеток. Кроме того, вирусы - это патогены, которые не имеют собственных биосинтетических или метаболических аппаратов и могут реплицироваться только внутри клетки. Находясь внутри клеток, эти патогены остаются нечувствительными к антибиотикам и могут быть элиминированы только благодаря разрушению инфицированных клеток. Таким образом, главная роль CTL - ограничение интрацеллюлярных инфекций, таких как вирусные инфекции и внутрицитоплазматические бактерии, некоторые протозойные инфекции (например токсоплазмоз). В основе механизмов Т-клеточной цитотоксичности лежат следующие процессы (рис. 2а):
CTL убивают клетки-мишени с высокой точностью, с минимальным вредом для соседних клеток. Эта точность - гарантия минимизации разрушения тканей. 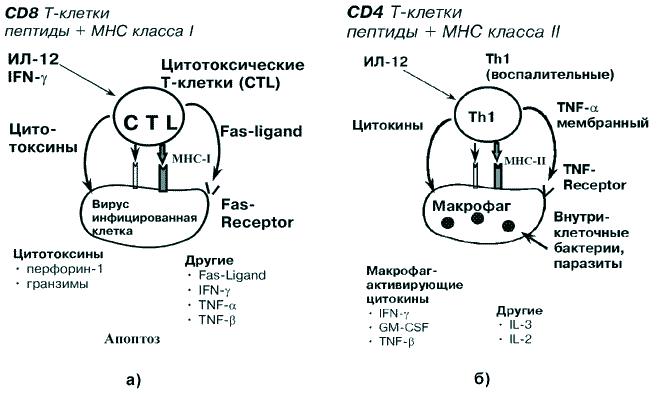
Рис. 2. Индукция клеточно-опосредованного иммунного ответа: Механизмы эффекторного действия воспалительных CD4 T-клеток (Th1)Макрофаги активируются благодаря воспалительным CD4 Т-клеткам. Некоторые микроорганизмы, такие как микобактерии (туберкулез, лепра) - это интрацеллюлярные патогены, которые находятся в везикулах, называемых фаголизосомы, макрофагов, где они недоступны для действия как антител, так и CTL. Эти микробы обычно сохраняют себя внутри фагоцита благодаря ингибиции слияния лизосомы с фаголизосомой, в которой они растут, или благодаря предупреждению излияния этих везикул, для чего требуется активация лизосомальных протеаз. Такие микроорганизмы элиминируются, когда происходит активация макрофагов с помощью воспалительных CD4 Т-клеток, т.е. воспалительные CD4 Т-клетки координируют ответ к интрацеллюлярным бактериям и паразитам. Зрелые CD4 Т-клетки (Th1) координируют иммунный ответ на эти интрацеллюлярные патогены благодаря синтезу и секреции комплекса цитокинов, которые действуют как локально, так и дистанционно. Активированные Th1 клетки выделяют следующие цитокины (рис. 2б):
Таким образом, воспалительные Т-клетки (Th1) координируют ответ макрофагов, вызывая индукцию антибактериальных механизмов в макрофагах, известную как активация макрофагов. Макрофаги требуют 2 сигнала для активации:
Активированные макрофаги подвергаются изменениям, которые значительно увеличивают их антибактериальную эффективность и усиливают иммунный ответ в ответ на интрацеллюлярные возбудители. Экспрессия поверхностных молекул МНС класса 2 увеличивается в активированных макрофагах, которые так же экспрессируют TNF-a рецепторы и секретируют TNF-a. Этот аутокринный стимул действует синергично с INF-g, секретируемых воспалительными CD4 Т-клетками (Th1) - что приводит к увеличению антибактеральной активности макрофагов. Частично это действие усиливается за счет продукции NO и радикалов кислорода. Таким образом, активированные макрофаги благодаря IFN-g, секретируемому зрелыми CD4 (Th1), играют главную роль в защите от патогенов, которые размножаются в везикулах макрофагов. 2.5.4. Гуморальный иммунный ответМногие бактерии, вызывающие заболевания у человека, размножаются в экстрацеллюлярной среде, кроме того, большинство интрацеллюлярных патогенгов могут распространяться от клетки к клетке через экстрацеллюлярные жидкости. Гуморальный иммунный ответ опосредуется молекулами антител, которые секретируются плазматическими клетками, и ведет к разрушению экстрацеллюлярных микроорганизмов, а также предотвращает распространение интрацеллюлярных инфекций. Имеются 3 пути реализации антителами защиты хозяина против инфекций: 1. Нейтрализация - когда антитела предупреждают прилипание патогенов к эпителию. 2. Опсонизация - когда антитела содействуют фагоцитозу бактерий. Комплексы антител с бактериями присоединяются к поверхности фагоцита за счет Fc-рецептора на поверхности фагоцита. 3. Активация комплемента. В-лимфоциты являются предшественниками плазматических клеток. В ранней фазе В-клеточного ответа важная роль принадлежит молекулам поверхностной мембраны Т-хелперов, относящимся к семейству TNF и известных как CD40-ligand, которые связываются с молекулами CD40 на поверхности В клеток. CD40 - это член семейства TNF-рецепторов, которые аналогичны TNF-рецептору на макрофагах и Fas-R на мишенях цитотоксических клеток. Активация T-клеток вызывает экспрессию на поверхности T-клеток молекул CD40-ligand, которые связываются с молекулой CD40 на B-клеточной поверхности. Связывание CD40-ligand с рецептором индуцирует поверхностную экспрессию B7.1 и B7.2, что вызывает активацию примитивных T-клеток. Связывание CD40 с CD40-Ligand помогает переходу В-клеток в клеточный цикл и является первоначальным для В-клеточного ответа на тимус-зависимые антигены (рис. 3). 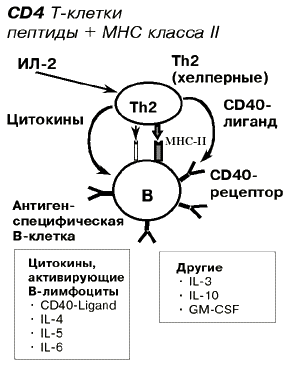 Рис. 3. Индукция гуморального иммунного ответа. Цитокины, секретируемые Т-хелперами (IL-4, 5, 6), необходимы для активации В клеток. Для успешного синтеза специфических антител необходим целый ряд межклеточных взаимодействий. Поверхностные иммуноглобулины на В-лимфоцитах служат в качестве рецепторов для антигена на В-лимфоцитах, а также играют важную роль в их активации, а именно:
Антигены, которые требуют Т-клеточной помощи для активации В-лимфоцитов, называются тимус-зависимыми. У лиц, у которых тимус недоразвит, нет эффективного иммунного ответа к тимус-зависимым антигенам. Некоторые микробные агенты, части микробной клетки, такие как бактериальные полисахариды, могут напрямую активировать В-клетки в отсутствие Th2-клеток и обеспечивать низкий уровень антител, но быстро продуцируемых, против многих важных бактериальных патогенов. Такие антигены называют тимус-независимыми. Антитела, индуцированные благодаря только одним микробным антигенам, являются менее разнообразными и менее функционально универсальными, чем индуцированные с помощью Т-клеток. Таким образом, антительный ответ инициируется, когда В-клетки связывают антиген и есть сигнал хелперных Т-клеток (Th2) или благодаря преимущественному действию некоторых микробных антигенов на B-лимфоциты. Общее правило адаптивного иммунитета - это то, что нативные антиген-специфические лимфоциты не могут быть активированы только одним антигеном. Нативные Т-клетки требуют ко-стимулирующего сигнала от профессиональных АРС. Нативные В-клетки требуют дополнительных сигналов, которые идут от зрелых хелперных Т-клеток (Th2) или, в некоторых случаях, напрямую - от микробных антигенов. Второй сигнал требуется для активации В-клеток при внедрении как тимус-зависимых, так и для тимус-независимых антигенов. Итак, первый сигнал - для активации В-лимфоцитов исходит от специфического рецептора антигена, это разпознавание специфического антигена. Второй сигнал исходит: а) в случае тимус-зависимых антигенов исходит от хелперных Th2 клеток, которые распознают фрагменты антигена, связанные с молекулами МНС класса 2 на поверхности В-лимфоцитов; б) в случае тимус-независимых антигенов исходит от самих антигенов. В-клетки становятся мишенями для зрелых хелперных Т-клеток, когда антигены связываются с поверхностными иммуноглобулинами на В-лимфоцитах, интернализируются и возвращаются на поверхность В-лимфоцитов как пептиды, связанные с молекулами МНС-класса II. Чтобы нативный антиген-специфический В-лимфоцит и антиген-специфический хелперный Т-лимфоцит, встретились для инициации Т-клеточно-зависимого антительного ответа, необходимо, чтобы В-клетки мигрировали через лимфоидные ткани. Известно, что В-клетки мигрируют через периферические лимфоидные органы во многом теми же путями, что и Т-клетки, причем число антиген-специфических В-клеток увеличивается в лимфоузлах, дренирующих место инфекции. Далее происходит цепь взаимосвязанных процессов [89].
Плазматическая клетка - это терминальная стадия дифференцировки B-клеток (табл. 10). Плазматические клетки секретируют антитела с высокой скоростью. Они не могут долго взаимодействовать с T-хелперами, так как у них снижено содержание поверхностных иммуноглобулиновых рецепторов и молекул МНС класса II (табл. 11). Таблица 10. Стадии дифференцировки B-клеток [89]
Таблица 11. Особенности, свойственные В-клеткам и плазматическим клеткам
Специальные регионы лимфоидных тканей обеспечивают микроокружение, где антиген-специфические В-клетки могут взаимодействовать со зрелыми Т-хелперами, специфичными для того же антигена. Антителосекретирующие плазматические клетки, которые дифференцируются в лимфоидных тканях, остаются в медуллярной зоне лимфоузлов и в красной пульпе селезенки. Обе эти зоны содержат большое количество макрофагов, которые помогают ограничивать инфекционные агенты в лимфоидной ткани. Другие пути миграции у IgА-секретирующих плазмобластов. Обычно их миграция начинается в пейеровых бляшках и через эфферентные лимфатические пути - к мезентериальным лимфоузлам и далее они переходят в кровь; с кровью они распределяются затем к Lamina propria тонкого кишечника, в пот, слезы, слюнные железы, грудное молоко. В итоге, В-клетки, покидающие герминативные центры, дифференцированы либо в антитело-секретирующие плазматические клетки, либо в В-клетки памяти. Который из этих 2-х путей будет иметь В-клетка - определяется благодаря сигналам от фолликулярных дендритных клеток и Т-клеток. Хотя сигнал для дифференцировки в плазматические клетки не достаточно хорошо известен, предполагается, что это CD23 на поверхности фолликулярных дендритных клеток. АнтителаГлавный вклад В-клеток в адаптивный иммунитет - это продукция антител в ответ на инфекцию. Антитела это антиген-специфические продукты В-клеток. Антитела формируют семейство протеинов плазмы, известных как иммуноглобулины. Антитела имеют 2 разных функции: Эти функции структурно различаются в молекуле антитела, когда одна часть специфически распознает антиген, тогда как другая - включает эффекторные механизмы. Структурно антиген-связывающие регионы резко различаются у разных молекул антител и известны как вариабельные регионы. В результате формируется разнообразие молекул антител, что является результатом высокоспециализированного механизма. Каждая молекула антител содержит тяжелые (H) и легкие (L) цепи, тяжелые цепи соединены друг с другом дисульфидными мостиками, и каждая тяжелая цепь соединена с легкой цепью дисульфидным мостиком. Существует только 2 типа легких цепей: l и k. Соотношение 2-х видов легких цепей варьирует от вида к виду. Например, у мышей отношение k к l равно 20:1, тогда как у человека 2:1, а у котов 1:20. Нарушения этого соотношения может иногда быть использовано для обнаружения нарушений в иммунной системе. Например, увеличение l легких цепей у человека может отражать присутствие l-продуцирующей В-клеточной опухоли. Имеется 5 основных типов тяжелых цепей: m, d, a, g, e. Это определяет изотип и функциональную активность молекул антител: это IgM, IgD, IgA, IgG, IgE. Каждый изотип имеет определенные функции в иммунном ответе и особенности, что определяется благодаря карбокситерминальной части тяжелой цепи, где они соединены с легкой цепью. При этом тяжелые и легкие цепи составляют константный (C) и вариабельные (V) регионы молекулы антитела. Fab-фрагмент - это антигенсвязывающий участок, а Fc - это константный уча-сток молекулы антитела. Каждая цепь имеет различную последовательность доменов, которые в свою очередь содержат 110 аминокислот. Легкие цепи имеют 2 домена, тяжелые - 4 (в частности, на примере IgG). Все домены имеют подобную последовательность аминокислот. В ответ даже на простой антиген возникает много различных молекул антител, каждая с уникальным аффинитетом и 5-ю специфичностями. Репертуар молекул антител - это 1011 различных молекул антител. Различия иммуноглобулиновИзотипы - различия между константными регионами молекул антител. Существует 5 изотипов антител, что соответствует 5 классам: IgA, IgM, IgG, IgD, IgE. Аллотипы - различия в константных областях тяжелых цепей, определяют аллели одного изотипа. (IgG1, IgG2, IgG3, IgG4, IgA1, IgA2). Идиотипы - различия в последовательности аминокислот VH и VL участков отдельной молекулы иммуноглобулина за счет реаранжировки генов указанных участков. Каждый изотип Ig имеет специализированные функции (табл. 12). Таблица 12. Сравнительная характеристика разных классов иммуноглобулинов [89]
2.5.5. Первичный иммунный ответПри первом попадании в организм антигена формируется первичный иммунный ответ, который характеризуется в ранней фазе преимущественной продукцией IgM-антител, тогда как доминирующий изотип антител, продуцируемый в раннем вторичном и последующх ответах - это обычно IgG или в некоторых случаях IgA и IgE-антитела. При вторичном ответе антитела продуцируются В-клетками памяти, которые уже переключились с продукции IgM на более зрелые изотипы и экспрессируют IgG, IgA или IgE на их поверхности, так же хорошо, как и высокий уровень молекул МНС класса II. В результате В-клетки памяти способны взаимодействовать со зрелыми Т-хелперами при низких дозах антигена. Повторные циклы иммунизации ведут к увеличению аффинитета антител, а также значительно быстрее достигается максимальный уровень синтеза антител.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||