Р. Я. МЕШКОВАРУКОВОДСТВО ПО ИММУНОПРОФИЛАКТИКЕ ДЛЯ ВРАЧЕЙ
На сегодняшний день дети с отягощенным анамнезом составляют подавляющее большинство пациентов, относящихся к так называемой "группе риска" возникновения поствакцинальных нежелательных реакций. Врачи испытывают большие трудности при определении возможности их иммунизации, хотя в соответствии с современными научными исследованиями именно таких детей можно и нужно прививать. Многолетние научные исследования, выполнявшиеся в нашей стране, внесли большой вклад в понимание клинических особенностей течения вакцинального периода у детей с различной патологией, а также возможность успешной вакцинаци их [6, 7, 8, 16]. Опираясь на эти данные как на базисные, представим далее состояние проблемы и перспективы иммунизации детей с различной патологией. Поскольку далеко не везде возможно проведение предварительного кожного тестирования перед вакцинацией, то для целей практического здравоохранения отечественными авторами [7] предлагается научно-обоснованный перечень рекомендуемых вакцин, введение которых детям с отклонениями в состоянии здоровья не вызывает в дальнейшем нежелательных реакций. На основании данных литературы и анализа отечественного и зарубежного опыта, нами предлагается современный перечень рекомендуемых вакцин в зависимости от вида патологии у ребенка. 5.1. Вакцинация пациентов с аллергопатологиейПоскольку "аллергия" - это достаточно широкое понятие, а заболевания могут иметь различную степень выраженности, то мы приводим в обобщенном виде рекомендации по вакцинации детей с аллергией, имея в виду цель достижения наилучшего иммунного ответа у ребенка и минимизацию возможных нежелательных реакций. 5.1.1. Предварительные замечанияНа основании исследования больших групп детей с атопией, вакцинированных против столбняка и дифтерии, было показано, что они способны давать высокий уровень специфических антител, не отличающийся от такового у детей без атопии. Так, было проведено изучение возможности вакцинации детей с атопическим дерматитом, бронхиальной астмой, пищевой аллергией. Всего у 135 детей, из них - с атопическим дерматитом - 68, бронхиальной астмой - 47, пищевой аллергией на коровье молоко - 11 детей. Все они получили вакцину MMR-1 [53]. Оказалось, что лишь в 2-х случаях были выявлены необычные реакции в виде сыпи и лихорадки. Авторы делают заключение, что аллергические заболевания не должны быть противопоказанием для вакцинации, но желательно проведение предварительного тестирования чувствительности к вакцине с помощью прик-теста, чтобы предотвратить нежелательные реакции. В другом исследовании проведена вакцинация против гриппа 1042 детям в возрасте от 3 до 18 лет с разными формами аллергии. Перед вакцинацией пациентам проводили прик-тестирование с вакциной, из них у 12 детей тестирование дало положительный результат и их не вакцинировали. Во всех остальных случаях побочных реакций не было [39]. Это лишний раз подтверждает важность предварительного тестирования для лиц с аллергией. По экстренным показаниям, детей с подострым атопическим дерматитом и бронхиальной астмой вакцинировали в очагах дифтерийной инфекции, при этом титр антидифтерийных и антистолбнячных антител был высоким и обеспечивал защиту детей [106]. Пациенты с аллергией на желатин могут дать анафилаксию на вакцинацию MMR, в связи с чем вакцинацию следует проводить с предосторожностями, с обязательным дополнительным выявлением сенсибилизации [148]. В Канаде пациентов с аллергией на яйцо перед вакцинацией MMR тестируют в кожном тесте с разведенной вакциной. Если кожные тесты оказываются положительными, то в дальнейшем проводят вакцинацию путем градуированного введения. Таковы требования Канадского национального комитета по иммунизации [128]. Подобные требования выдвигаются и в других странах [167]. С 1987 по 1993 г. в Великобритании было провакцинировано против кори 200 детей с указаниями в анамнезе на пищевую аллергию на яйцо. В 199 случаях побочных эффектов вакцинации не было, а у 1 ребенка развилась анафилактическая реакция (0,5%). Авторы сделали заключение, что аллергия на яйцо не может быть постоянным медотводом. Как и в предыдущих случаях рекомендуется перед вакцинацией проводить кожное тестирование с коревой вакциной [33]. Подобные результаты были получены и в другом исследовании, в котором коревая вакцина вводилась детям с аллергией на яйцо, при этом у 5 из них были положительными реакции кожного тестирования на вакцину. Оказалось, что после иммунизации 1-й дозой побочные реакции (местные) были у 4 детей, лечение не требовалось [20]. Поскольку вакцины против паротита, кори, гриппа готовят на куриных эмбрионах, то вакцинация детей с аллергией на куриное яйцо должна проводиться с особыми предосторожностями. В исследовании, проведенном во Франции, у 9 из 17 детей с аллергией на яйцо вакцины вызвали локальные или местные реакции [166]. Как видим из приведенных данных, дети с аллергопатологией могут быть иммунизированы как убитыми, так и живыми вакцинами, при этом уровень протективного иммунитета у них сравним со здоровыми. Многие авторы рекомендуют предварительное кожное тестирование с вакцинами. 5.1.2. Рекомендуемые вакцины для детей с аллергопатологиейВ рамках календаря профилактических прививок, важно определить оптимальный перечень вакцин для детей, страдающих аллергическими заболеваниями, а так же наиболее приемлемые условия проведения вакцинации (табл. 33). Таблица 33. Оптимальные интервалы после введения препаратов иммуноглобулинов, используемых для разных целей и вакцинацией живыми вирусными вакцинами [67]
Примечания. условия проведения вакцинации: 5.1.3. Вакцинация больных, получающих СИТВ некоторых случаях встает вопрос о вакцинации пациентов с атопическими заболеваниями, находящихся на лечении аллергенами - специфической иммунотерапии. Это может быть при атопической бронхиальной астме, поллинозе, круглогодичном аллергическом рините и др. 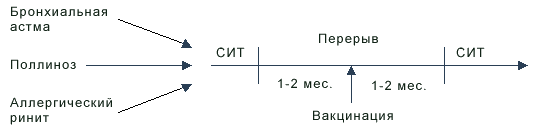 Рис. 4. Сроки прерывания курса специфической иммунотерапии (СИТ) при проведении плановой иммунизации При решении вопроса о проведении плановой вакцинации следует прервать курс аллерготерапии (см. рис. 4) не менее, чем на 2 мес. Спустя 1-2 мес. после вакцинации при отсутствии поствакциональных осложнений лечение аллерговакцинами можно будет продолжить. 5.2. Вакцинация пациентов с имунодефицитами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| I. | Врожденных иммунодефицитов. |
| II. | Приобретенных (вторичных) иммунодефицитов, возникающих вследствие: - ВИЧ-инфекции; - онкопатологии; - терапии цитостатиками; - радиации. - применения больших доз кортикостероидов; - других причин (травмы, стрессы, операции, голодание и др.). |
Серьезные осложнения возникают вследствие вакцинации таких лиц живыми вирусными и бактериальными вакцинами, в связи с чем Наблюдательный комитет по практике иммунизации (ACIP) рекомендует практикующим врачам в США придерживаться целого ряда рекомендаций [67].
5.2.2. Вакцинация пациентов со вторичными иммунодефицитами
На сегодняшний день имеется целый ряд особенностей вакцинации таких пациентов, зависящих не от возраста больных, а от причин возникновения иммунодефицита.
Во-первых, эти пациенты в подавляющем большинстве случаев не должны получать живые вакцины. Кроме того, вакцина ОПВ не должна вводиться лицам, контактирующим с иммунодефицитными пациентами дома. Таким образом, те, у кого иммунный статус изменился из-за приобретенных условий (например, ВИЧ-инфекция, лейкемия, лимфома и т.п.), или те, у кого иммунная система ослаблена терапией (например, лечение кортикостероидами), не должны получать ОПВ из-за возможного риска паралитического заболевания.
Если полиовакцина показана для иммунодефицитного пациента или членов их семей, то следует вводить ИПВ.
Если немедленная защита против кори требуется для пациентов с противопоказаниями к коревой вакцинации, то пассивная иммунизация с помощью иммуноглобулина в дозе 0,25 мл/кг массы (максимальная доза равна 15 мл), должна быть проведена как можно скорее после контакта. Контактные симптоматические ВИЧ-инфицированные и другие иммунодефицитные лица должны получить иммуноглобулин, несмотря на их предыдущий вакцинальный статус. Однако иммуноглобулин в обычных дозах не будет эффективным у таких пациентов. Для иммунодефицитных пациентов рекомендуется доза 0,5 мл/кг в/м, что соответствует дозе белка 82,5 мг/кг (максимальная доза = 2475 мг) на в/м введение. Если пациент с ВИЧ-инфекцией получает иммуноглобулин в дозе 100-400 мг/кг в/в с регулярными интервалами и последняя доза была введена в пределах 3 недель после контакта с корью, то повышенная доза не обязательна.
Во-вторых, убитые вакцины могут быть введены пациентам с иммунодефицитами, хотя известно, что ответ к таким вакцинам у них будет субоптимальным. Дозы вводимых вакцин для них обычные, графики те же, что и для здоровых лиц.
В-третьих, для особых групп пациентов, включая лиц с функциональной или анатомической аспленией, дополнительно вводят некоторые вакцины, такие как пневмококковая или против гемофильной инфекции.
Описан случай врожденной асплении у ребенка, при которой он был вакцинирован против Hib-инфекции в возрасте 2,4 и 6 месяцев. После вакцинации титры специфических антител достигали протективного уровня [107].
Спленэктомия производится в связи с разными причинами, но в любом случае пациенты должны быть привиты пневмококковой вакциной. Анализ специфического антительного ответа у спленэктомированных пациентов был проведен исследователями в Швеции: у 53 спленэктомированных пациентов (из них - 11 с болезнью Ходжкина, 13 - неходжкинской лимфомой, 9 - с идиопатической тромбоцитопенической пурпурой и 20 - с посттравматической спленэктомией) исследовали содержание IgG и IgA антител к антигенам пневмококков типов 6А и 19F. Оказалось, что у всех, кроме пациентов с неходжкинской лимфомой, титр антител соответствовал контролю. Был сделан вывод, что детей и подростков со спленэктомией следует вакцинировать против пневмококковой инфекции, причем лучше до операции [72].
В Великобритании описаны случаи гибели пациентов со спленэктомией спустя 5 и 8 лет после операции в связи с развитием летальной пневмококковой инфекции, а пациенты не были привиты против нее [128].
После спленэктомии дети могут быть вакцинированы против Hib-инфекции и столбняка, причем после вакцинации у пациентов имеет место повышение титров специфических антител [107].
В-четвертых, вакцинация пациентов на фоне химио- или радиотерапии не должна проводиться, так как антительный ответ у них будет крайне низким. Пациенты, вакцинируемые до старта иммуносупрессивной терапии, должны быть спустя 3 месяца после окончания курса лечени ревакцинированы согласно прививочного календаря или дополнительными вакцинами.
Пациенты с лейкемией в стадии ремиссии, у которых химиотерапия закончена 3 месяца тому назад, так же могут получить живые вирусные вакцины.
В-пятых, большинство исследователей считает, что стероидная терапия не является противопоказанием для введения живых вирусных вакцин, если лечение кратковременное (менее 2-х недель), проводится низкими дозами гормонов, либо вводятся топические гормоны (в глаза, нос, аэрозоли, внутрисуставное введение). Более того, последние данные свидетельствуют, что у лиц, получающих гормоны в аэрозольной форме, нет повышения тяжести реакций на живые вакцины. Большинство клиницистов считает, что доза преднизолона 2 мг/кг (суточная доза 20 мг в день) безопасна для вакцинации живыми вирусными вакцинами.
Кортикостероиды, используемые в более высоких дозах (более 2-х недель) снижают иммунный ответ к вакцинам. Пациенты должны иметь 3-х месячный перерыв после окончания гормонотерапии перед введением живых вирусных вакцин.
В-шестых, часто болеющих детей рекомендуется прививать с использованием календарных вакцин и, кроме того, дополнительно использовать АКТ-Хиб, так как у всех детей обнаруживается повышение уровня специфических антител, особенно после второй вакцинации, проведенной спустя 1 месяц [31]. Такие дети нуждаются в ежегодной вакцинации против гриппа, начиная с 6-месячного возраста [75].
Активная тактика вакцинации, предлагаемая в последние годы в отношении часто болеющих детей (приказ МЗ РФ № 375), дает основание значительно расширить перечень заболеваний, при которых стало возможным вакцинировать практически сразу же после выздоровления.
Однако разумная доля консерватизма в отношении определения сроков медотводов, на наш взгляд, должна сохраняться, чтобы рассчитывать на полноценное включение иммунной системы в реализацию защитных механизмов после вакцинации.
В связи с этим ниже предлагается не только перечень рекомендуемых вакцин, но и возможные сроки медотводов (табл. 34).
Анализ случаев гриппа А и В у госпитализированных пульмонологических больных показал, что детей с высоким риском нозокомиальных инфекций следует вакцинировать во время эпидемических подъемов в стационаре, так как из их числа заболевает 14%, тогда как среди детей с низким риском заболевает лишь 4% [149].
Таблица 34. Рекомендуемые вакцины для детей со вторичными иммунодефицитами (группа часто болеющих детей)
| |||||||||||||||||||||||||||
Примечания.
* вакцинация детей из группы ЧБД по эпидемпоказаниям может осуществляться после выздоровления или на фоне заболевания.
Условия проведения вакцинации:
1 – Отделение иммунопрофилактики (наблюдение аллерголога-иммунолога);
2 – Кабинет аллерголога-иммунолога в поликлинике.
5.2.3. Вакцинация пациентов с врожденными иммунодефицитами
Пациенты с врожденными иммунодефицитами не должны получать ОПВ из-за повышенного риска заболеваний, связанных с вакциной.
Для вакцинации людей с иммунодефицитами и их домашнего окружения нужно использовать ИРВ, а не ОПВ. Реципиент ОПВ должен избегать близких физических контактов с больным иммунодефицитом в течение 4-6 недель после вакцинации (т.е. в течение периода максимального выделения вируса вакцины). Если такого контакта избежать нельзя, необходимы строгие гигиенические меры после контакта, например, мытье рук после смены пеленок, и исключение контактов со слизистой (через соски). Из-за того, что иммунодефицит возможен у других детей, рожденных в семье, где один ребенок уже имеет иммунодефицит, нельзя вводить ОПВ членам такой семьи, до того как будет определен иммунный статус реципиента и других детей в семье. У пациентов с врожденным иммунодфицитом риск паралитического заболевания выше, чем у тех, кто имеет втричный иммунодефицит. Известно, что защитная иммунная реакция на ИРВ у людей с иммунодефицитом не может быть гарантирована, но вакцина для них безопасна и при ее введении все-таки достигается некоторая защита.
Теоретически репликация вакцинного вируса паротита может иметь место у пациентов с первичными и вторичными иммунодефицитами вследствие супрессии иммунного ответа при с лейкемии, лимфомах или генерализованной малигнизации, а также в случае лечения кортикостероидами, антиметаболитами или облучением. Пациенты при указанных состояниях не должны получать живую паротитную вакцину, а для снижения риска паротитной инфекции у таких пациентов необходимо вакцинировать лиц из ближайшего к ним окружения.
В последние годы показано, что при таких врожденных иммунодефицитах, как селективная IgA-недостаточность, синдром Вискотта-Олдрича, а также при синдроме ОВИН (общая вариабельная иммунная недостаточность), пациентов следует прививать против Hib-инфекции. Титр специфических антител у них значительно возрастает после повторных введений вакцины [31].
Как уже подчеркивалось, однозначного подхода к иммунизации не разработано, поэтому представляем сведения, имеющиеся как в отечественной, так и в иностранной литературе [67, 7, 6, 16] (табл. 35).
Таблица 35. Рекомендуемые вакцины для детей с врожденными иммунодефицитами
|
Примечание: плановая вакцинация проводится в период ремиссии очагов инфекции на фоне патогенетической терапии (антибактериальная, иммуноглобулинетерапия и др.). Дополнительно за 7-10 дней до и 10-14 дней после вакцинации назначают антигистаминные препараты.
5.2.4. Вакцинация ВИЧ-инфицированных пациентов
ВИЧ-инфицированные пациенты имеют субоптимальный иммунологический ответ на вакцинацию. Важно знать уровень СD4 Т-клеток накануне вакцинации, так как, если он ниже 200х109, то эффект вакцинации сомнителен (Borleffs J.C., 1994).
Рекомендации по использованию различных вакцин у ВИЧ-инфицированных детей первых лет жизни представлены на основании данных Jay P. Sanford et al. (Guide to HIV/AIDS Therapy, 1997).
Таблица 36. Рекомендуемые вакцины для ВИЧ-инфицированных детей (асимптоматические и клинические формы)
|
Примечания. Вакцина БЦЖ не рекомендуется. Однако в регионах, где повышено число больных туберкулезом, ВОЗ рекомендует БЦЖ-иммунизацию для асимптоматичных ВИЧ-позитивных детей.
Вакцина ОПВ (живая полиомиелитная) может быть введена ВИЧ-позитивным асимптоматическим детям (вирусоносители), но поскольку в их семьях могут оказаться другие иммунокопрометированные родственники, то при тесном контакте с вакцинированными у них может развиться ВАП (вакцинассоциированный полиомиелит). В связи с этим ОПВ рекомендуется заменять на инактивированную вакцину при иммунизации ВИЧ-инфицированных детей.
Изучение антительного ответа к паротиту, краснухе, кори, столбняку у ВИЧ-инфицированных детей показало, что ответ у них ниже, чем у здоровых детей. Так, уровень антител к кори был соответственно равен 50% по сравнению с 93%, к паротиту - 25% и 75% и к краснухе 21% и 90% соответственно. В то же время авторы отмечают, что вакцинация не повлияла на изменение симптоматики ВИЧ-инфекции [60].
Детей с ВИЧ-инфекцией вакцинировали против Hib-инфекции. Спустя 4 месяца у 11 из 18 детей концентрация специфических антител составляла 0,40 мкг/мл. После проведения им бустерной иммунизации титры антител повысились и составили 0,82 мкг/мл, но были достоверно ниже, чем у здорового контроля. Тем не менее вакцинировать таких детей следует, понимая при этом, что защитный иммунитет у них будет слабее, чем у здоровых сверстников [139].
ВИЧ-инфицированных детей вакцинировали MMR и оказалось, что гуморальный иммунный ответ развивается у 33% детей (у 2 из 10 детей были обнаружены антитела класса G к кори, у 4 из 10 - к паротиту и у 4 из 10 - к краснухе). Персистенции вакцинных вирусов не выявили ни в одном случае. На основании полученных данных, авторы пришли к выводу о том, что иммунологический ответ у таких детей достаточен для предотвращения естественной инфекции [64].
Это позволило авторам сделать заключение, что из-за высокого риска осложнений, связанных с естественной коревой инфекцией и отсутствием серьезных реакций после вакцинации, рекомендуется введение MMR всем асимптоматичным ВИЧ-инфицированным, а также всем ВИЧ-инфицированным с наличием симптомов даже, если иммунная реакция у них может быть снижена.
С другой стороны, поскольку есть теоретический риск возрастания вирусной нагрузки ВИЧ, следующей за MMR-вакцинацией [67], разработаны рекомендации по вакцинации ВИЧ-инфицированных в зависимости от тяжести иммунодефицита, в частности: следует воздержаться от MMR или других корь-содержащих вакцин лицам с тяжелыми иммунодефицитами, что определяется по абсолютному числу Т-лимфоцитов: а) СД4+ Т-лимфоцитов меньше, чем 750/мм3 - для детей моложе 12 месяцев, б) меньше, чем 500/мм3 - для детей 1-5 лет, в) меньше, чем 200/мм3 - для лиц старше 6 лет. Другой вариант - содержание СД4+ Т-лимфоцитов: а) меньше, чем 15% от общего числа лимфоцитов для детей моложе 13 лет, б) меньше, чем 14% для лиц 13 лет и старше.
В целом рекомендуется вакцинация против кори, паротита, краснухи (MMR) для ВИЧ-инфицированных лиц без наличия у них иммунитета к кори и при отсутствии тяжелого иммунодефицита.
Помимо этого, ВИЧ-инфицированные пациенты с тяжелым иммунодефицитом и другими симптоматическими формами, попавшие в контакт с корью, должны получать иммуноглобулин, вне зависимости от предварительного вакцинального статуса.
Поскольку иммунный ответ как на живые, так и на убитые вакцины может быть снижен при прогрессировании ВИЧ-инфекции, то ранняя вакцинация наиболее предпочтительна для индукции иммунитета.
ВИЧ-инфицированные грудные дети без тяжелого иммунодефицита должны получить рутинную вакцинацию против кори (MMR) так скоро, как возможно до достижения ими возраста 1 года. Тестирование асимптоматичных лиц для идентификации ВИЧ-инфекции не является необходимым перед разрешением им вакцинации.
Как в случае вакцинации детей с ВИЧ-инфекцией, так и взрослых следует придерживаться основной рекомендации, а именно: как можно более ранняя вакцинация пациентов после установки диагноза ВИЧ-инфекции.
Таблица 37. Рекомендации по рутинной иммунизации ВИЧ-инфицированных взрослых в США (1997 г.)
| ||||||||||||||||||||||
Примечание. Введение живых вакцин ОПВ и БЦЖ противопоказано.
| © 2000-2007 НИИАХ СГМА |
|